题目内容
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y为金属元素,且Y的原子序数小于X和Z的最外层电子数之和,Z原子的最外层电子数与核外电子总数之比为3:8。下列说法正确的是( )
A.原子半径:r(W)>r(Y)>r(X)
B.X与Y组成的化合物中均不含共价键
C.X的简单气态氢化物的热稳定性比Z的强
D.W的氧化物对应的水化物酸性比Z的强
【答案】C
【解析】
Z原子的最外层电子数与核外电子总数之比为3:8,即最外层电子数与内层电子数之比为3:5,则Z原子的核外有三层,即Z元素为S;X、Z同主族,则X元素为O,Y的原子序数大于8且小于X和Z的最外层电子数之和12,所以金属元素Y为Na,短周期主族元素X、Y、Z、W原子序数依次增大,所以W元素为Cl,据此分析作答。
根据上述分析可知,X元素为O,Y元素为Na,Z元素为S,W元素为Cl。
A.Na是短周期主族元素中原子半径最大的元素,Cl和S相邻并且Cl原子比O多一电子层,所以原子半径:r(Na)>r(Cl)>r(O),A项错误;
B.X与Y组成的化合物有Na2O或Na2O2,其中Na2O2由钠离子和![]() 离子构成,
离子构成,![]() 含有非极性共价键,B项错误;
含有非极性共价键,B项错误;
C.S的非金属性小于O,所以O的简单气态氢化物的热稳定性比S的强,C项正确;
D.应该是W的则根据氧化物对应的水化物酸性比Z的强,D项错误;答案选C。

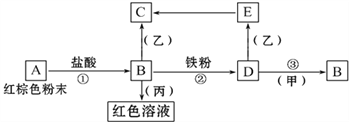
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2