题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,又知四种元素的单质常温常压下有两种气体、两种固体。请回答下列问题:
(1)由A、B两种元素可形成E、F两种化合物,写出其中一种化介物分解生成另一种化合物的化学方程式__________________________________________________________________。
(2)由C、D两元素组成的常见化台物,其水溶液呈碱性,原因是(用离子方程式表示)__________________________________________________________________。
(3)由A、B、D三种元素中的两种可分别形成甲、乙两种粒子,它们均为-1价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲与乙反应的离子方程式为___________。
(4)一定条件下,DB2气体与足量的B单质充分反应生成20 g气态化合物,放出24.6 kJ热量,写出其热化学方程式_________________________________________________________。
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则M极是该电池的________________极,N极的电极反应式为:______________________________________。
(1)2H2O2====2H2O+O2↑
(2)S2-+H2O![]() HS-+OH-
HS-+OH-
(3)HS-+OH-====s2-+H2O
(4)2SO2 (g)+O2 (g)![]() 2SO3(g);ΔH=-196.8 kJ/mol
2SO3(g);ΔH=-196.8 kJ/mol
(5)负 O2+4e-+2H2O====4OH-

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为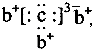 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为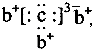 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
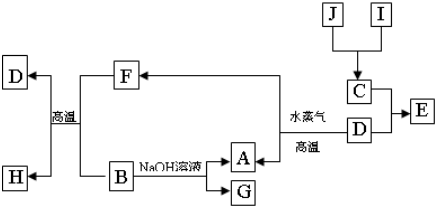
 Al(OH)3+OH-
Al(OH)3+OH-