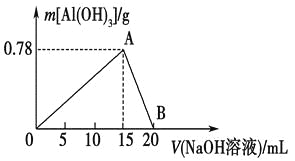
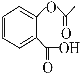
题目内容
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为______________,Y的轨道表示式为_________________;
(2)YX2的电子式是______________,分子构型为_________,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是_______(填名称),键角为_______,中心原子的杂化形式为_______。
【答案】1s22s22p4 ![]()
![]() 直线型 sp CS2 极性 非极性 甲烷 109°28 sp3
直线型 sp CS2 极性 非极性 甲烷 109°28 sp3
【解析】
化合物YX2、ZX2中X、Y、Z的核电荷数小于18,三元素处于短周期,Y原子的最外层中p能级的电子数等于前一能层电子总数,Y原子只能有2个能层,核外电子排布为1s22s22p2,故Y为碳元素;X原子最外能层的p能级中有一个轨道充填了2个电子,外围电子排布为ns2np4,处于ⅥA族,且X和Y具有相同的电子层数,故X为O元素;Z与X在周期表中位于同一主族,则Z为S元素,据此分析解答。
根据上述分析,X为O元素,Y为碳元素,Z为S元素。
(1)X为O元素,其电子排布式为1s22s22p4,Y为C元素,原子核外电子排布为1s22s22p2,故其轨道表示式为![]() ,故答案为:1s22s2p4;
,故答案为:1s22s2p4;![]() ;
;
(2)YX2为CO2,分子中C原子与O原子之间形成2对共用电子对,C的价层电子对数=2+![]() =2,C采用sp杂化,为直线型,其电子式是
=2,C采用sp杂化,为直线型,其电子式是![]() ;故答案为:
;故答案为:![]() ;直线形;sp;
;直线形;sp;
(3)C与S形成的化合物是CS2,CS2中碳原子和硫原子之间存在极性键,C的价层电子对数=2+![]() =2,C采用sp杂化,为直线型,分子中正负电荷中心重合,为非极性分子,故答案为:CS2;极性键;非极性;
=2,C采用sp杂化,为直线型,分子中正负电荷中心重合,为非极性分子,故答案为:CS2;极性键;非极性;
(4)Y的氢化物中分子构型为正四面体的是甲烷,甲烷分子中碳原子含有4个共价单键,且不含孤电子对,所以碳原子采用sp3杂化,所以分子为正四面体型,键角为109°28′,故答案为:甲烷;109°28′;sp3。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。