题目内容
4.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )| A. | CH3-CH=CH-CHO | B. | CH3-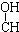 - -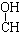 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-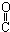 -CH2-CHO -CH2-CHO |
分析 含-OH、-COOH可发生酯化反应,含碳碳双键、-CHO可发生还原反应、加成反应,含-OH且与-OH相连C的邻位C上有H可发生消去反应,以此来解答.
解答 解:A.含碳碳双键、-CHO可发生还原反应、加成反应,不能发生酯化、消去反应,故A不选;
B.含-OH可发生酯化、消去反应,不能发生还原、加成反应,故B不选;
C.含-OH可发生酯化、消去反应,含-CHO可发生还原、加成反应,含有碳碳双键,可发生加成反应,故C选;
D.含-CHO可发生还原反应、加成反应,含-OH可发生酯化反应,但不能发生消去反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、醛、烯烃性质的考查,选项D为解答的易错点,注意醇消去反应的结构特点,题目难度不大.

练习册系列答案
相关题目
14.下列性质的递变中,正确的是( )
| A. | O、Na、S的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次增强 | ||
| C. | HF、NH3、SiH4的稳定性依次增强 | D. | HCl、HBr、HI的还原性依次减弱 |
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温下,0.1 mol•L-1醋酸钠溶液中含有Na+和CH3COO-的总数为0.2NA | |
| B. | 常温下,将0.1 mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA | |
| C. | 2 g NO2和44 g N2O4的混合气体中所含原子的总数为3NA | |
| D. | 0.1 mol甘油醛中含有双键的数目为0.3NA |
19.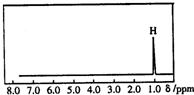 核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
 核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )| A. | CH3C(CH3)3 | B. | CH3CH2CH3 | C. | CH2=CHCH3 | D. | (CH3)2CHCH3 |
9.有下列五种物质:①2-甲基丁烷;②2,2-二甲基丙烷;③戊烷;④丙烷;⑤丁烷.它们的沸点由高到低的顺序正确的是( )
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ④⑤②①③ | D. | ③①②⑤④ |
16.常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 向0.1mol•L-1pH=2的HF溶液加水稀释,$\frac{c({H}^{+})}{c(HF)}$增大 | |
| B. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O溶液和NH4Cl溶液等体积混合:c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
13.X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.M是地壳中含量最高的金属元素.下列说法正确的是( )
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 | |
| C. | 用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和2:1的化合物 |

 ,②
,② 中氯原子较难水解.
中氯原子较难水解. 或
或 .
. .
.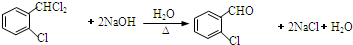 .
. .
. .
. ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$