题目内容
19.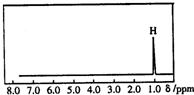 核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )
核磁共振是利用在有机物中的1H的原子核所处的“化学环境”(即其附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置化学位移,符号为δ)也就不同.如图所示的核磁共振图谱表示的是下列有机物中的( )| A. | CH3C(CH3)3 | B. | CH3CH2CH3 | C. | CH2=CHCH3 | D. | (CH3)2CHCH3 |
分析 分子中含几种位置的H原子,则核磁共振氢谱就有几种不同的信号峰,根据图示可知,该有机物分子中中含有1种H原子,据此对各选项进行判断.
解答 解:核磁共振氢谱中给出1种峰,说明该分子中的有1种H原子,
A.CH3C(CH3)3中有1种H原子,核磁共振氢谱中给出1种峰,故A正确;
B.CH3CH2CH3中有2种H原子,核磁共振氢谱中给出2种峰,故B错误;
C.CH2=CHCH3中有3种H原子,核磁共振氢谱中给出3种峰,故C错误;
D.(CH3)2CHCH3中有2种H原子,核磁共振氢谱中给出2种峰,故D错误;
故选A.
点评 本题主要考查核磁共振氢谱与有机物中氢原子的种类关系,题目难度不大,明确等效氢的判断是解题的关键,注意掌握常见有机物结构及核磁共振氢谱中吸收峰与等效H原子之间的关系.

练习册系列答案
相关题目
9.在1.01KPa和298K条件下,2molH2生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-484kJ/mol | B. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ/mol |
10.下列有机反应方程式与反应类型均正确的是( )
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl 加成反应 | |
| B. | 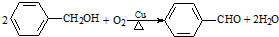 氧化反应 氧化反应 | |
| C. |  加成反应 加成反应 | |
| D. | 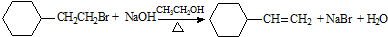 取代反应 取代反应 |
7.下列有关热化学方程式的书写及对应的表述均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热△H=-110.5 kJ•mol-1 |
14.化学与生活、社会密切相关,下列说法正确的是( )
| A. | 用NaOH溶液雕刻工艺玻璃上的纹饰 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 | |
| D. | 淀粉、蛋白质、脂肪是人体必需的营养物质.它们都是天然高分子化合物,一定条件下都能发生水解和氧化反应 |
4.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. | CH3-CH=CH-CHO | B. | CH3-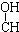 - -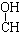 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-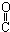 -CH2-CHO -CH2-CHO |
8.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| B. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA | |
| C. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA |
9.碳酸钠一种重要的化工原料.工业碳酸钠纯度约为 98%,其中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO42-等杂质,提纯工艺线路如图:
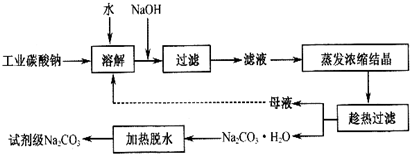
有关物质的溶度积如表:
请回答下列问题:
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.

有关物质的溶度积如表:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.
 ;
;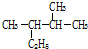 用系统命名法命名为2,3-二甲基戊烷;
用系统命名法命名为2,3-二甲基戊烷; ;
;