题目内容
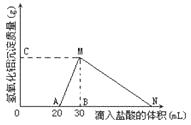
 在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示.
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示.问:(1)此溶液中除含有AlO2-外,还同时含有
0.02
0.02
molOH-
OH-
离子;(2)用离子方程式表示MN段发生的反应是
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
(3)原溶液中,c (AlO2-) 是
1
1
mol/L(4)加盐酸到点N处,滴入的HCl溶液体积共为
60
60
ml.分析:(1)由图可知,滴加盐酸开始不产生沉淀,故溶液中还含有OH-,开始加入的20mL盐酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)等于20mL盐酸中n(HCl);
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水;
(3)由图可知,从20mL~30mL发生的反应为AlO2-+H++H2O═Al(OH)3↓,该阶段消耗的盐酸体积为30mL-20mL=10mL,根据方程式计算溶液中n(AlO2-),再根据c=
计算浓度;
(4)由图可知,加盐酸到点N处,氢氧化铝恰好完全溶解,此时溶液中阴离子为Cl-,根据电荷守恒可知n(Cl-)=n(AlO2-)+n(OH-),据此计算氢氧化铝溶解需要盐酸的物质的量,进而计算体积.
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水;
(3)由图可知,从20mL~30mL发生的反应为AlO2-+H++H2O═Al(OH)3↓,该阶段消耗的盐酸体积为30mL-20mL=10mL,根据方程式计算溶液中n(AlO2-),再根据c=
| n |
| V |
(4)由图可知,加盐酸到点N处,氢氧化铝恰好完全溶解,此时溶液中阴离子为Cl-,根据电荷守恒可知n(Cl-)=n(AlO2-)+n(OH-),据此计算氢氧化铝溶解需要盐酸的物质的量,进而计算体积.
解答:解:(1)由图可知,滴加盐酸开始不产生沉淀,故溶液中还含有OH-,开始加入的20mL盐酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)=n(H+)=0.02L×1mol/L=0.02mol,
故答案为:0.02;OH-;
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)由图可知,从20mL~40mL发生的反应为AlO2-+H++H2O═Al(OH)3↓,该阶段消耗的盐酸体积为40mL-20mL=20mL,由方程式可知溶液中n(AlO2-)=n(H+)=0.01L×1mol/L=0.01mol,故c(AlO2-)=
=1mol/L,
故答案为:1;
(4)由图可知,加盐酸到点N处,氢氧化铝恰好完全溶解,此时溶液中阴离子为Cl-,根据电荷守恒可知n(Cl-)=n(AlO2-)+n(OH-)=0.01mol+0.02mol=0.03mol,故此阶段消耗的盐酸的体积为
=0.03L=30mL,故N点滴入的HCl溶液体积共为30mL+30mL=60mL,
故答案为:60.
故答案为:0.02;OH-;
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)由图可知,从20mL~40mL发生的反应为AlO2-+H++H2O═Al(OH)3↓,该阶段消耗的盐酸体积为40mL-20mL=20mL,由方程式可知溶液中n(AlO2-)=n(H+)=0.01L×1mol/L=0.01mol,故c(AlO2-)=
| 0.01mol |
| 0.01L |
故答案为:1;
(4)由图可知,加盐酸到点N处,氢氧化铝恰好完全溶解,此时溶液中阴离子为Cl-,根据电荷守恒可知n(Cl-)=n(AlO2-)+n(OH-)=0.01mol+0.02mol=0.03mol,故此阶段消耗的盐酸的体积为
| 0.03mol |
| 1mol/L |
故答案为:60.
点评:本题考查铝及其化合物的性质、有关图象的化学计算等,难度中等,清楚各阶段发生的反应是解题的关键,注意元素化合物知识的掌握.

练习册系列答案
相关题目