��Ŀ����
(19��)��1����֪��1 mol H��H����1 mol I��I��1 mol H��I���ֱ���Ҫ���յ�����Ϊ436 kJ��151 kJ��299 kJ,���������͵ⷴӦ����1 mol HI��Ҫ ����ų��������ա��� kJ��������
��2����֪�ڳ��³�ѹ�£�
��CH3OH��l��+O2��g��=CO��g��+2H2O��l������H1=��442.8 kJ��mol
��2CO(g)+O2(g)��2CO2(g)����H2 ����566.0 kJ��mol
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ__________________________________________
��3����֪�ϳɰ����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g) 2NH3(g)����H= -92.2 kJ��mol��1
2NH3(g)����H= -92.2 kJ��mol��1
�±��Ǻϳɰ���Ӧ��ij�¶���2.0L���ܱ������н���ʱ����õ����ݣ�
���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
���ݱ������ݼ��㣺
�ٷ�Ӧ���е�2Сʱʱ�ų�������Ϊ kJ��
��0~1Сʱ��N2��ƽ����Ӧ���� mol��L��1��h��1
�۴������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K= (������λС��)��
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1mol����ѧƽ���� �����ƶ��������Ӧ�����淴Ӧ�����ƶ�����
��1���ų� �� 5.5��ÿ��2�֣�
��2��CH3OH��l��+ 3/2O2��g��=CO2��g��+2H2O��l������H=-725.8 kJ/mol
��3���� 27.66 ��0.05 ��0.15 ������Ӧ��ÿ��3�֣�
��������
�����������1����Ӧ�жϿ�1 mol H��H����1 mol I��I��Ҫ���յ�����Ϊ436+151=587kJ���γ�2Ħ�������ͷŵ�����Ϊ299��2=598kJ,���Էų��ı����յĶ࣬��ӦΪ�ų�������ÿ����2Ħ���⻯�⣬�ų�������Ϊ598-587=11kJ����������1Ħ���⻯��ų�5.5kJ����������2�����ݸ�˹���ɣ���+�ڡ�2�����Ȼ�ѧ����ʽΪ��CH3OH��l��+ 3/2O2��g��=CO2��g��+2H2O��l������H=-725.8 kJ/mol����3���ٽ��е�2Сʱ��������Ӧ��1.50-1.20=0.3Ħ�����ʷ�Ӧ����Ϊ0.3��92.2=27.66kJ���ڷ�Ӧ1Сʱ��������Ӧ��4.50-4.20=0.30Ħ����������Ӧ��0.10Ħ�������Ե�����ƽ������=0.10��2��1=0.05 mol��L��1��h��1����ƽ��ʱ������Ũ��Ϊ0.5mol/L��������Ũ��Ϊ0.5 mol/L��������Ũ��Ϊ1.5 mol/L����ƽ�ⳣ��=(0.5)2/[0.5��(1.5)3]=0.15���ܣ����ٶ�����1Ħ��ʱ������Ũ����=12/1��23=0.125<0.15������ƽ�������ƶ���
���㣺��Ӧ�ȵļ��㣬��˹���ɣ�ƽ�ⳣ���ļ��㣬����Ũ���̺�ƽ�ⳣ���ж��ƶ�����

 ʱ�䣨h��
ʱ�䣨h�� 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���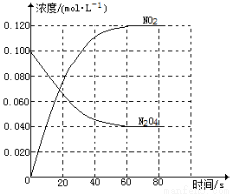
 2NH3 ( g ) ��H = -92.0 kJ/mol�������¶��µ�1 mol N2 ��3 mol H2 ����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ������������ʧ��
2NH3 ( g ) ��H = -92.0 kJ/mol�������¶��µ�1 mol N2 ��3 mol H2 ����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ������������ʧ��