题目内容
19.如图所示是一些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分.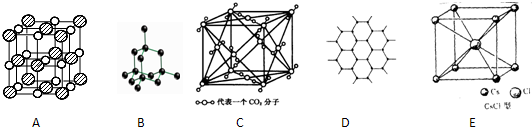
(1)其中代表金刚石的是(填写编号字母,下同)B,其中每个碳原子与4个碳原子最接近且距离相等.属于原子晶体晶体.
(2)其中代表石墨的是D,其中每个正六边形占有的碳原子数平均为2个.
(3)其中表示NaCl的是A,每个钠离子周围与它最接近且距离相等的氯离子有6个,每个钠离子周围与它最接近且距离相等的钠离子有12个,每个氯离子周围紧邻的钠离子相连接而成的空间几何体为正八面体.
(4)代表CsCl的是E,它属于离子晶体,每个铯离子与8个氯离子紧邻.
分析 (1)金刚石是原子晶体,晶体中每个碳原子与4个共价单键对称地与相邻的4个碳原子相结合;
(2)石墨属于混合型晶体,层和层之间以分子间作用力相连,同一层内每一个碳原子形成3给正六边形,所以每个正六边形占有的碳原子数平均为6÷3=2;
(3)氯化钠是离子晶体,配位数均是6,所以每个钠离子周围与它最接近且距离相等的氯离子有6个.每个钠离子周围与它最接近且距离相等的钠离子有12个.每个氯离子周围紧邻的钠离子相连接而成的空间几何体为正八面体;
(4)氯化铯也是离子晶体,阴阳离子的配位数均是8.
解答 解:(1)金刚石是空间立体网状结构,所以B图为金刚石的结构,每个碳原子连接4个碳原子,原子间以共价键相结合,属于原子晶体,
故答案为:B;4;原子晶体;
(2)石墨属于混合型晶体,层和层之间以分子间作用力相连,所以D图为石墨的结构,同一层内每一个碳原子形成3个正六边形,所以每个正六边形占有的碳原子数平均为6÷3=2,
故答案为:D;2;
(3)氯化钠是离子晶体,配位数均是6,所以A图为氯化钠的结构,每个钠离子周围与它最接近且距离相等的氯离子有6个,每个钠离子周围与它最接近且距离相等的钠离子有12个,每个氯离子周围紧邻的钠离子相连接而成的空间几何体为正八面体,
故答案为:A;6;12;正八面体;
(4)氯化铯也是离子晶体,阴阳离子的配位数均是8,即每个铯离子与8个氯离子紧邻,所以E图为氯化钠的结构,故答案为:E;离子;8.
点评 本题主要考查了各种常见类型的晶体的结构,以及各种晶体的性质,难度不大,解题的关键是要对基本知识要熟记尤其是结构图.

练习册系列答案
相关题目
10.为提纯下表所列有机物(括号内为所含的少量杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择最佳提纯的方法,将序号填入表中.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
(Ⅱ)方法:A.过滤 B.分液 C.蒸馏 D.蒸发
(3)在B的操作中,使用的主要玻璃仪器是(梨形)分液漏斗.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
(Ⅱ)方法:A.过滤 B.分液 C.蒸馏 D.蒸发
| 要提纯的物质 (少量杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙酸乙酯 (乙酸) | 苯 (苯酚) |
| (1)选用试剂 | ||||
| (2)分离方法 |
7.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A. | 第一电离能:Y可能大于或小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X强于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
14.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:Al-3e-=Al3+;总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:Al-3e-=Al3+;总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
11.元素的化学性质主要决定于( )
| A. | 核外电子数 | B. | 核内质子数 | C. | 核内中子数 | D. | 最外层电子数 |
8.X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
| A. | 原子序数:X<Y | B. | 电负性:X<Y | C. | 离子半径:X>Y | D. | 原子半径:X<Y |


