题目内容
6.反应A+3B═4C+2D,在不同条件下反应,其平均反应速率v(X)(表示反应物的消耗速率或生成物的生成速率)如下,其中反应速率最快的是( )| A. | v(A)=0.4mol/(L•s) | B. | v(B)=0.8mol/(L•s) | C. | v(C)=1.2mol/(L•s) | D. | v(D)=0.7mol/(L•s) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位保持一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,
A.$\frac{v(A)}{1}$=0.4mol/(L•s);
B.$\frac{v(B)}{3}$=0.267mol/(L•s);
C.$\frac{v(C)}{4}$=0.3mol/(L•s);
D.$\frac{v(D)}{2}$=0.35mol/(L•s),
故反应速率v(A)>v(D)>v(C)>v(B),
故选A.
点评 本题考查化学反应速率快慢比较,也可以转化为同一物质表示的速率进行比较,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.若某池(电解池或原电池)的总反应离子反应式是Cu+Zn2+═Cu2++Zn,关于此电池的有关说法正确的是( )
| A. | 该池可能是原电池,也可能是电解池 | |
| B. | 该池只能是原电池,且电解质溶液为硝酸 | |
| C. | 该池只能是电解池,且金属铜为该电解池的阴极 | |
| D. | 该池只能是电解池,电解质溶液可以是硫酸锌 |
14.室温下,一气态烃与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少50mL,再通过NaOH溶液,体积又减少了40mL,原烃的分子式是( )
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C3H8 |
1.丙烷的分子结构可简写成键线式结构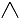 ,有机物A的健线式结构为
,有机物A的健线式结构为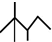 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
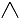 ,有机物A的健线式结构为
,有机物A的健线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 有机物A的一氯取代物只有5种 | |
| B. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种,其中一种名称为2,2,3-三甲基-2-戊烯 |
18.pH=0时,下列各离子组能大量共存的是( )
| A. | Ba2+、Na+、I-、ClO- | B. | K+、Fe2+、SO42-、NO3- | ||
| C. | K+、Mg2+、Br-SO42- | D. | Na+、K+、Clˉ、SiO32- |
15.下列对废弃塑料制品的处理方法中,最为恰当的是( )
| A. | 切成碎片后混入土壤中 | |
| B. | 露天焚烧 | |
| C. | 倾倒在偏僻的海滩或海洋中 | |
| D. | 应用化学方法加工成再生塑料制品、防水涂料或燃油等产品 |
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: