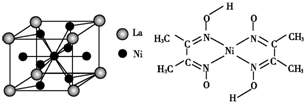
题目内容
7.下列化合物中,含有非极性键的离子化合物是( )| A. | Ba(OH)2 | B. | H2O2 | C. | Na2O2 | D. | CaCl2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键.
解答 解:A.氢氧化钡中钡离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,属于离子化合物,故A错误;
B.双氧水分子中O-O、O-H原子之间分别存在非极性键、极性键,属于共价化合物,故B错误;
C.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,属于离子化合物,故C正确;
D.氯化钙中钙离子和氯离子之间只存在离子键,属于离子化合物,故D错误;
故选C.
点评 本题考查化学键和化合物的关系,明确物质构成微粒是解本题关键,知道离子键、共价键的区别,易错选项是D,注意氯化钙中两个氯离子之间不存在化学键.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
18.甲烷分子中4个氢原子被苯基取代,可得如图所示分子,对该分子的描述正确的是( )


| A. | 此物质是苯的同系物 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 此分子的一氯取代产物有3种 | D. | 此物质分子式为C25H22 |
15.已知短周期元素a、b、c、d、e的原子序数依次增大、其氢化物中a、b、c、d、e的化合价如表,下列说法不正确的是( )
| 元素 | a | b | c | d | e |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 元素a、c、d的最高价氧化物都属于酸性氧化物 | |
| B. | 元素c、d、e的氢化物稳定性和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 元素周期表中,元素c位于金属和非金属分界线附近,其单质常用作光电池材料 | |
| D. | 元素b、d、e的原子半径和离子半径均依次减小 |
12.如图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是( )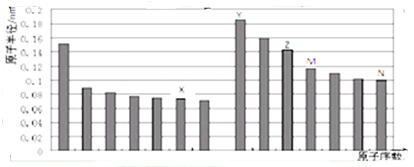

| A. | 金属性:Z>Y | |
| B. | 气态氢化物的稳定性:M>N | |
| C. | X和Y形成的化合物中可能含共价键 | |
| D. | Z元素的离子半径是本周期元素离子半径最小的 |
3.为研究铁及其化合物的性质,某探究小组进行如下实验:将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间,取适量浸泡后的溶液滴入少量KSCN溶液,未见溶液呈血红色.请根据要求回答问题:
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡. | 溶液呈血红色 | 乙同学的观点正确 (填“正确”或“错误”). |
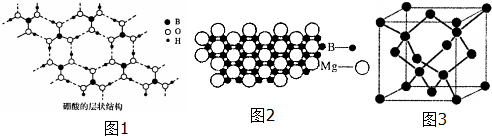
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④