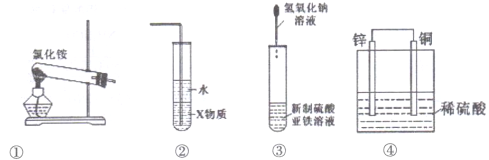
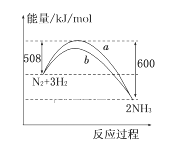
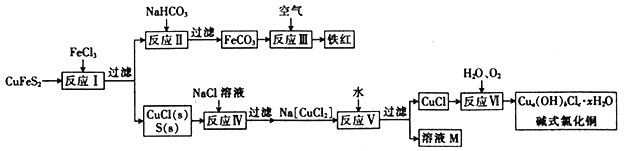
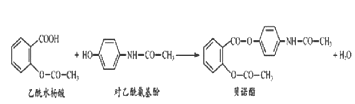
题目内容
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素。
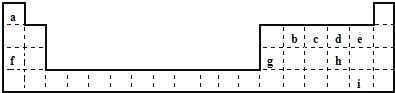
请回答下列问题:
(1)b、c、d三种元素的原子半径最大的是_________ (填元素符号);f、g对应的离子中离子半径较大的是_________(填离子符号)。
(2)i元素在周期表中的位置为_________;在元素 b、c、d、e、h、i的氢化物中,热稳定性最强的是________(填氢化物的化学式)。
(3)d、f、h三种元素形成的具有较强还原性的化合物A,与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯气体,该反应的离子方程式为_________ ;生成 标准状况下56L二氧化氯时,转移电子的数目为_________个。
(4)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的离子方程式:①________;②________。所得溶液中溶质物质的量浓度为__________(液体的体积变化忽略不计)。
【答案】 C Na+ 第四周期,第ⅦA族 HF SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O 2.5 NA 2Na+2H2O=2Na++2OH—+H2↑ 2Al+2OH—+2H2O=2AlO2—+3H2↑ 1mol/L
【解析】
根据元素周期表知,a、b、c、d、e、f、g、h、i分别是H、C、N、O、F、Na、Al、S、Br。
(1)同一周期元素,原子半径随着原子序数增大而减小,所以b、c、d三种元素的原子半径最大的是C;电子层结构相同的离子,离子半径随着原子序数增大而减小,f、g对应的离子中离子半径较大的是Na+,故答案为:C;Na+;
(2)i为Br元素,位于第四周期第VIIA族;在元素b、c、d、e、h、i中非金属性最强的是F元素,则HF的热稳定性最强,故答案为:第四周期,第ⅦA族;HF;
(3)d、f、h三种元素形成的具有较强还原性的化合物A为亚硫酸钠,亚硫酸钠与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯气体,同时生成硫酸根离子和水,离子方程式为:SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O;56L氯气的物质的量=![]() =2.5mol,由方程式可知转移电子数为2.5mol,即2.5NA个,故答案为:SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O;2.5NA;
=2.5mol,由方程式可知转移电子数为2.5mol,即2.5NA个,故答案为:SO32—+2ClO3—+2H+=SO42—+2ClO2↑+H2O;2.5NA;
(4)f、g元素的单质在水中完全反应生成的溶液中只含有一种,说 明Na、Al恰好反应生成NaAlO2,发 生 的 反 应 有2Na+2H2O=2Na++2OH—+H2↑、2Al+2OH—+2H2O=2AlO2—+3H2↑,根据方程式知,Na和Al的物质的量相等,设 Na、Al的物质的量都是 ymol,23y+27y=5.0,y=![]() =0.1mol,根据Na原子守恒知n(NaAlO2)=0.1mol,则c(NaAlO2)=
=0.1mol,根据Na原子守恒知n(NaAlO2)=0.1mol,则c(NaAlO2)=![]() =1mol/L,故答案为:2Na+2H2O=2Na++2OH—+H2↑;2Al+2OH—+2H2O=2AlO2—+3H2↑;1mol/L。
=1mol/L,故答案为:2Na+2H2O=2Na++2OH—+H2↑;2Al+2OH—+2H2O=2AlO2—+3H2↑;1mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】锶(Sr)与镁是同主族元素.锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等。
(1)锶(Sr)位于周期表的第___周期___族,过氧化锶(SrO2)中锶元素的化合价为______。
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式______。
(3)金属锶很活泼,在空气中易被氧化,可保存在______中(填序号)。
①水 ②酒精 ③煤油
(4)锶的性质与钙类似。已知:CaCl2 易溶于水,CaF2难溶于水,请写出硝酸锶和氟化钠反应的离子方程式______。
(5)隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体,该反应的化学方程式:______。
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10—amolL—1,c(OH—)=10—bmolL—1,已知a+b=12.向该溶液中逐滴加入 pH=X 的盐酸,测得混合溶液的部分pH如表所示。
Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的 pH | |
① | |||
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
若忽略溶液混合前后的体积变化,则X为______(用数字填空)。