题目内容
向硝酸银溶液中加入盐酸,直到反应完全为止,结果反应后溶液质量恰等于原硝酸银溶液的质量.如果该HCl溶液的密度为1.10g/cm3,该溶液的物质的量的浓度为 .
考点:物质的量浓度的相关计算
专题:
分析:发生反应:HCl+AgNO3═AgCl↓+HNO3,由质量守恒可知:m(盐酸)+m(AgNO3溶液)=m(AgCl)+m(HNO3溶液),反应后溶液质量恰等于原硝酸银溶液的质量,则有m(盐酸)=m(AgCl),设氯化银的质量为143.5g,则原盐酸溶液的质量为143.5g,根据n=
计算AgCl物质的量,由氯元素守恒n(HCl)=n(AgCl),根据V=
计算溶液体积,根据c=
计算该盐酸溶液的物质的量的浓度.
| n |
| m |
| m |
| ρ |
| n |
| V |
解答:
解:发生反应:HCl+AgNO3═AgCl↓+HNO3,由质量守恒可知:m(盐酸)+m(AgNO3溶液)=m(AgCl)+m(HNO3溶液),反应后溶液质量恰等于原硝酸银溶液的质量,则有m(盐酸)=m(AgCl),
设氯化银的质量为143.5g,则原盐酸溶液的质量为143.5g,
由氯元素守恒n(HCl)=n(AgCl)=
=1mol,
盐酸溶液体积为
=
L,
则溶液物质的量浓度为
=7.67mol/L,
故答案为:7.67mol/L.
设氯化银的质量为143.5g,则原盐酸溶液的质量为143.5g,
由氯元素守恒n(HCl)=n(AgCl)=
| 143.5g |
| 143.5g/mol |
盐酸溶液体积为
| 143.5g |
| 1100g/L |
| 143.5 |
| 1100 |
则溶液物质的量浓度为
| 1mol | ||
|
故答案为:7.67mol/L.
点评:本题考查化学反应方程式的计算、物质的量浓度有关计算,难度不大,确定盐酸质量等于氯化银的质量是关键,注意利用赋值法简化计算.

练习册系列答案
相关题目
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、1 L 1 mol/L的NaClO 溶液中含有ClO-的数目为NA |
| B、78 g 苯含有C=C 双键的数目为3NA |
| C、常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| D、标准状况下,6.72 L 氯气与水充分反应转移的电子数目为0.3NA |
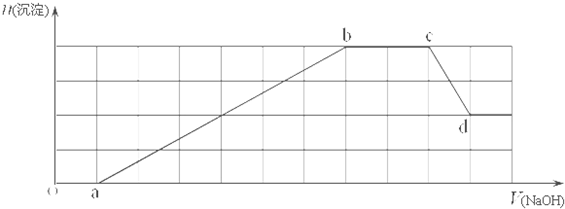
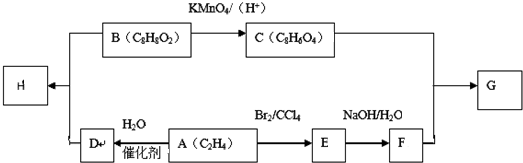
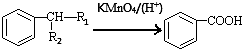 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)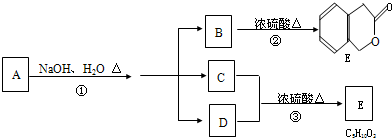
 金属钠和过氧化钠分别与水反应有很多值得探究的问题.
金属钠和过氧化钠分别与水反应有很多值得探究的问题.
