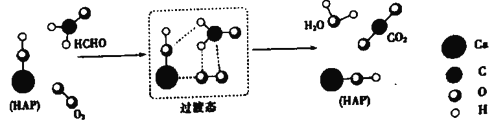
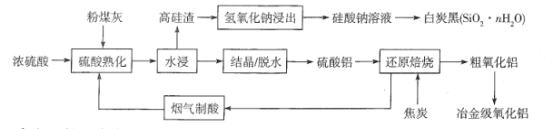
题目内容
【题目】用NaOH溶液吸收烟气中的SO2,将所得的吸收液用三室膜电解技术处理,原理如图所示.下列说法错误的是

A.电极a为电解池阴极
B.阳极上有反应HSO3—-2e—+H2O=SO42—+3H+发生
C.当电路中通过1mol电子的电量时,理论上将产生0.5mol H2
D.处理后可得到较浓的H2SO4和NaHSO3产品
【答案】D
【解析】
A.从图中箭标方向“Na+→电极a”,则a为阴极,与题意不符,A错误;
B.电极b为阳极,发生氧化反应,根据图像“HSO3-和SO42-”向b移动,则b电极反应式HSO3-–2e-+H2O=SO42-+3H+,与题意不符,B错误;
C.电极a发生还原反应,a为阴极,故a电极反应式为2H++2e–=H2↑,通过1mol电子时,会有0.5molH2生成,与题意不符,C错误;
D.根据图像可知,b极可得到较浓的硫酸,a极得到亚硫酸钠,符合题意,D正确;
答案为D。

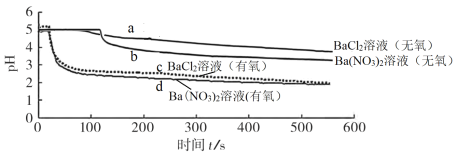
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2