题目内容
10.下列有关实验现象和解释或结论都正确的选项是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将SO2通入氢氧化钠的酚酞试液中 | 红色褪去 | SO2具有漂白性 |
| B | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液并水浴加热 | 无银镜产生 | 淀粉没有水解 |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,观察溶液颜色变化 | 红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向2mL 0.lmol/L的AgNO3溶液中先加入0.lmol/L的NaCl溶液3滴,再滴加0.lmol/L的NaI溶液3滴,观察沉淀颜色变化 | 先白色沉淀后出现黄色沉淀 | 溶度积:AgI比AgCl更小 |
| A. | A、 | B. | B | C. | C | D. | D |
分析 A.二氧化硫为酸性氧化物;
B.淀粉水解生成葡萄糖,检验葡萄糖应在碱性条件下;
C.碳酸钠溶液中存在水解平衡,加氯化钡与碳酸根离子反应;
D.硝酸银过量,均为沉淀的生成.
解答 解:A.二氧化硫为酸性氧化物,则SO2通入氢氧化钠的酚酞试液中,溶液褪色,发生复分解反应,与漂白性无关,故A错误;
B.淀粉水解生成葡萄糖,检验葡萄糖应在碱性条件下,没有加碱至碱性不能检验,故B错误;
C.碳酸钠溶液中存在水解平衡,加氯化钡与碳酸根离子反应,水解平衡逆向移动,则红色变浅,故C正确;
D.硝酸银过量,均为沉淀的生成,则不能比较AgI、AgCl的Ksp,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的检验、水解平衡、Ksp的比较为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
18.14C是一种放射性同位素,在一定条件下,14N可转变为14C,下列说法正确的是( )
| A. | 14C和14N互为同位素 | B. | 14N和C60是同素异形体 | ||
| C. | ${\;}_{6}^{14}$C核素中的中子数为8 | D. | 14CO2的摩尔质量为44 |
15.如图为元素周期表短周期的一部分,Z原子的电子层数 为n,最外层电子数为2n+1.下列叙述错误的是( )
| R | W | X | |
| Y | Z |
| A. | R、Y、Z的最高价氧化物对应的水化物的酸性依次增强 | |
| B. | R、W和氢三种元素形成的阴离子有2种以上 | |
| C. | RY2分子中每个原子的最外层均为8电子结构 | |
| D. | X和Z氢化物的热稳定性和还原性均依次减弱 |
2.A、B、C、D、E是原子序数依次增大的五种短周期主族元素.已知:①A、B、C、D、E分别位于三个不同的短周期,②在元素周期表中,A与C、B与D分别同主族,③B原子的最外层电子数等于A与C原子序数之和的一半,下列叙述错误的是( )
| A. | 简单离子的半径:r(D)>r(E)>r(B)>r(C) | |
| B. | 最高价氧化物对应水化物的酸性:E>D | |
| C. | A2B2、C2B2所含有的化学键类型完全相同 | |
| D. | A、B、C、D四种元素形成的化合物溶于水呈酸性 |
19. 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )
 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )| A. | 随pH增大,c(CH3COOH)与c(CH3COO-)的比值减小 | |
| B. | pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 25℃时,CH3COOH的电离常数K=1×10-2.75 | |
| D. | pH=5的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
11.根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
(1)能显+1价,还能显-1价的元素是H(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为NaOH、Mg(OH)2、Al(OH)3(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为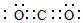 .
.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为
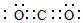 .
.(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如所示.