题目内容
下列各组反应中的△H大小比较正确的是( )
| 热化学方程式 | △H大小比较 | |||
| A | S(g)+O2(g)=SO2(g)△H1 | △H1>△H2 | ||
| S(s)+O2(g)=SO2(g)△H2 | ||||
| B | 2H2(g)+O2(g)=2H2O(1)△H1 | △H1<△H2 | ||
| 2H2(g)+O2(g)=2H2O(g)△H2 | ||||
| C | CH3COOH(aq)+NaOH(aq)=CH3COOHNa(aq)+H2O(1)△H1 | △H1<△H2 | ||
| HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)△H2 | ||||
| D | 2Na(s)+
| △H1>△H2 | ||
| 2Na(s)+O2(g)=Na2O2 △H2 |
| A、A | B、B | C、C | D、D |
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:A、等量的气态硫具有的能量大于固态硫;
B、等量的气态水具有的能量大于液态水;
C、弱酸电离时吸热;
D、等量的钠反应生成过氧化钠消耗的氧气多.
B、等量的气态水具有的能量大于液态水;
C、弱酸电离时吸热;
D、等量的钠反应生成过氧化钠消耗的氧气多.
解答:
解:A、固体硫变化为气态硫需要吸收热量,所以气态硫放热多,由于反应热为负值,所以△H1<△H2 故A错误;
B、氢气和氧气反应生成液态水放热多,由于反应热为负值,所以△H1<△H2 ,故B正确;
C、CH3COOH(aq)+NaOH(aq)=CH3COOHNa(aq)+H2O(1)反应中醋酸是弱电解质,电离过程是吸热过程,反应放出的热量较少,则反应△H1>△H2 ,故C错误
D、等量的钠反应生成过氧化钠消耗的氧气多,则生成过氧化钠放出的热量多,所以△H1>△H2,故D正确;
故选BD.
B、氢气和氧气反应生成液态水放热多,由于反应热为负值,所以△H1<△H2 ,故B正确;
C、CH3COOH(aq)+NaOH(aq)=CH3COOHNa(aq)+H2O(1)反应中醋酸是弱电解质,电离过程是吸热过程,反应放出的热量较少,则反应△H1>△H2 ,故C错误
D、等量的钠反应生成过氧化钠消耗的氧气多,则生成过氧化钠放出的热量多,所以△H1>△H2,故D正确;
故选BD.
点评:本题考查了反应热大小的比较,注意把握放热反应的反应热为负值,放热越多△H越小,题目难度不大.

练习册系列答案
相关题目
下列因果关系叙述正确的是( )
| A、SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C、Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
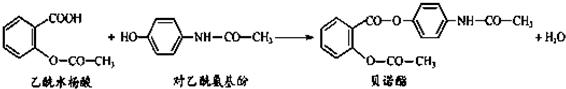
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A、贝诺酯分子中有三种含氧官能团 |
| B、对乙酰氨基酚核磁共振氢谱中共有四个峰 |
| C、乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应 |
| D、贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A、无色透明的溶液中:MnO4-、SO42-、K+、Fe2+ |
| B、c(OH-)/c(H+)=1012的水溶液中:K+、ClO-、S2-、Cl- |
| C、水电离出的c(H+)=10-12mol/L中:K+、AlO2-、CH3COO-、CO32- |
| D、能使加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- |
下列物质中所含分子数最多的是( )
| A、4℃时2.7mL 水 |
| B、2.24L一氧化碳(标准状况下) |
| C、6.02×1022个氯化氢分子 |
| D、4.9g 磷酸 |
在相同条件下,燃烧时对大气污染程度最小的燃料是( )
| A、液化气 | B、煤油 | C、煤饼 | D、木柴 |
下列说法中正确的是( )
| A、胶体带电荷,而溶液呈电中性 |
| B、胶体区别与其他分散系的本质特征是分散质粒子的大小 |
| C、某元素从化合态变为游离态时,该元素一定被还原 |
| D、醋酸、纯碱、石灰石、氨水分别属于酸、碱、盐和电解质 |