题目内容
某研究性学习小组的同学利用下图来验证一定质量的铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数,已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体.

(1)写出A中铜与硝酸反应的一个化学方程式 ;
(2)C装置的作用是 ;
(3)反应结束后,打开活塞K2,并通入O2,若实验中有NO产生,则在D中可观察到的现象是 ;
(4)反应前要先打开活塞K1持续通入一段时间的N2,其理由是 ;
(5)利用A装置中反应后的溶液还可确定铜的质量分数,方法是:取出A中反应后的溶液,先向其中加入足量的 溶液,然后再进行 , , , .(填操作名称)

(1)写出A中铜与硝酸反应的一个化学方程式
(2)C装置的作用是
(3)反应结束后,打开活塞K2,并通入O2,若实验中有NO产生,则在D中可观察到的现象是
(4)反应前要先打开活塞K1持续通入一段时间的N2,其理由是
(5)利用A装置中反应后的溶液还可确定铜的质量分数,方法是:取出A中反应后的溶液,先向其中加入足量的
考点:探究物质的组成或测量物质的含量,硝酸的化学性质,性质实验方案的设计
专题:实验探究和数据处理题
分析:铜银合金与浓硝酸反应生成硝酸铜、硝酸银以及二氧化氮气体,如硝酸浓度降低时可能生成NO,经B浓硫酸干燥后,在C中冷却,NO2完全转化生成N2O4,D中气体通入氧气,如由NO,则可生成红综合的NO2气体,最后用氢氧化钠溶液吸收尾气,防止污染空气,利用A装置中反应后的溶液加入硝酸银溶液,生成AgCl沉淀,经过滤、洗涤、干燥后称量可确定银的质量,进而可测得铜的质量分数,以此解答该题.
解答:
解:铜银合金与浓硝酸反应生成硝酸铜、硝酸银以及二氧化氮气体,如硝酸浓度降低时可能生成NO,经B浓硫酸干燥后,在C中冷却,NO2完全转化生成N2O4,D中气体通入氧气,如由NO,则可生成红综合的NO2气体,最后用氢氧化钠溶液吸收尾气,防止污染空气,利用A装置中反应后的溶液加入硝酸银溶液,生成AgCl沉淀,经过滤、洗涤、干燥后称量可确定银的质量,进而可测得铜的质量分数,
(1)铜和浓硝酸反应生成二氧化氮,过程中随硝酸浓度变稀后铜和稀硝酸反应生成一氧化氮气体,反应的可能化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)在低于0℃时几乎只有无色的N2O4晶体,则C可用于将NO2转化为N2O4并与NO分离,故答案为:将NO2转化为N2O4并与NO分离;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体,
故答案为:出现红棕色气体;
(4)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮,从而干扰实验结论,
故答案为:排除装置中的空气,防止干扰验证性试验;
(5)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,计算得到合金中铜的质量分数,则应先加入足量盐酸,然后将生成的沉淀进行过滤、洗涤、干燥、称量,
故答案为:盐酸;过滤;洗涤;干燥;称量.
(1)铜和浓硝酸反应生成二氧化氮,过程中随硝酸浓度变稀后铜和稀硝酸反应生成一氧化氮气体,反应的可能化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)在低于0℃时几乎只有无色的N2O4晶体,则C可用于将NO2转化为N2O4并与NO分离,故答案为:将NO2转化为N2O4并与NO分离;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体,
故答案为:出现红棕色气体;
(4)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮,从而干扰实验结论,
故答案为:排除装置中的空气,防止干扰验证性试验;
(5)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,计算得到合金中铜的质量分数,则应先加入足量盐酸,然后将生成的沉淀进行过滤、洗涤、干燥、称量,
故答案为:盐酸;过滤;洗涤;干燥;称量.
点评:本题以银和硝酸反应为载体考查实验探究,明确NO和二氧化氮性质是解本题关键,再结合化学平衡分析解答,知道实验操作顺序,明确各个仪器的作用,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、35Cl和37Cl互为同素异形体 | ||||
| B、O2和O3是氧元素的两种同位素 | ||||
| C、35Cl和37Cl中35、37表示的是质量数 | ||||
D、1
|
下列有关实验原理、方法和结论都正确的是( )
| A、某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显紫色,则原溶液中有I- |
| B、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- |
| D、某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+ |
下列说法正确的是( )
| A、1 molCO2为22.4L |
| B、标准状况下,1mol水体积为22.4L |
| C、相同状况下,1molH2和O2所占体积相同 |
| D、只有在标准状况下气体摩尔体积才是22.4mol/L |
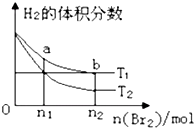 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g)?2HBr(g)△H<0. 当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g)?2HBr(g)△H<0. 当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A、由图可知:T2>T1 |
| B、a、b两点的反应速率:b>a |
| C、为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 |
| D、T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
 用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( ) 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
 ,有机物甲的结构简式为
,有机物甲的结构简式为 ,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.
,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.