题目内容
A,B两元为某周期ⅡA族和ⅢA族元素,若A的原子序数为x,则B的原子序数可能是( )
①x+1 ②x+81 ③x+11 ④x+18 ⑤x+25.
①x+1 ②x+81 ③x+11 ④x+18 ⑤x+25.
| A、①③ | B、②④ |
| C、①③⑤ | D、②③④⑤ |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:元素周期表中,从第四周期开始出现过渡元素,第ⅠA、ⅡA之后是第ⅢB,在第六、七周期中的过渡元素又出现镧系和锕系,根据周期表的结构来回答.
解答:
解:因为是同一周期的IIA族,即同一横行往右一个主族,在第二、三周期原子序数增加1,因而可以x+1;
又因为IIA族与IIIA族元素在第四周期起有过渡元素,因而又可以为x+11;
在第六、七周期的过渡元素中又出现镧系和锕系,因而又可以为x+25.
故选C.
又因为IIA族与IIIA族元素在第四周期起有过渡元素,因而又可以为x+11;
在第六、七周期的过渡元素中又出现镧系和锕系,因而又可以为x+25.
故选C.
点评:本题考查学生元素周期表的结构知识,注意把握周期表中的列和族的关系及副族元素的位置,题目难度不大.

练习册系列答案
相关题目
下列化学用语表达正确的是( )
| A、乙酸的结构简式:C2H4O2 |
B、氢氧化钠的电子式: |
C、Cl离子的结构示意图: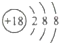 |
| D、NaClO的电离方程式:NaClO=Na++Cl-+O2- |
温度不变恒容的容器中进行反应A?B,若反应物浓度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1所需反应时间应为( )
| A、等于10s |
| B、等于12s |
| C、大于12s |
| D、小于12s |
下列关系正确的是( )
| A、密度:CCl4>CHCl3>H2O>苯 |
| B、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| C、含氢量:甲烷>乙烯>乙炔>苯 |
| D、同物质的量物质燃烧耗O2量:环己烷>己烷>苯>苯甲酸 |
某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是( )
| A、一定形成共价键 |
| B、一定形成离子键 |
| C、可能形成共价键,也可能形成离子键 |
| D、以上说法都不对 |
化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.下列化学用语中,书写错误的是( )
A、硫离子的结构示意图: |
B、NH4Cl的电子式: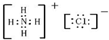 |
C、CO2的电子式: |
| D、次氯酸的结构式:H-O-Cl |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 LCO2所含的原子数为1.5NA | ||
| B、常温常压下,48 g O3含有的氧原子数为3NA | ||
| C、标准状况下,22.4 L SO3中所含原子数为4NA | ||
D、标准状况下,1 L水所含分子数为
|
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍.下列说法不正确的是( )
| A、原子半径:Z>W>R |
| B、对应的氢化物的热稳定性:R>W |
| C、W离子的还原性强于R离子 |
| D、W与X、W与Z形成的化合物的化学键类型完全相同 |
下列说法正确的是( )
| A、在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在隔热的容器中快速混合,并不断搅拌,用温度计测量混合液的最高温度 |
| B、往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 |
| C、将溴乙烷与氢氧化钾混合液加热,再滴加硝酸银溶液,观察有淡黄色沉淀生成,可证明溴乙烷中含有溴 |
| D、润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |