题目内容
 为了研究金属腐蚀的原理,某学生做如图实验:先向试管A中加入少量水,将具支试管B的导管末端插入A的水面下:将经过酸洗除锈的铁钉,用蒸馏水洗净后,再用饱和食盐水浸泡一下,投入具支试管B中,并迅速用橡胶塞寒紧试管B.一段时间后,试管A中的导管内液面上升,铁钉表而逐渐产生铁锈.请用电极反应式表示上述过程中电化学腐蚀的反应原理:负极
为了研究金属腐蚀的原理,某学生做如图实验:先向试管A中加入少量水,将具支试管B的导管末端插入A的水面下:将经过酸洗除锈的铁钉,用蒸馏水洗净后,再用饱和食盐水浸泡一下,投入具支试管B中,并迅速用橡胶塞寒紧试管B.一段时间后,试管A中的导管内液面上升,铁钉表而逐渐产生铁锈.请用电极反应式表示上述过程中电化学腐蚀的反应原理:负极Fe-2e-═Fe 2+
Fe-2e-═Fe 2+
,正极O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.分析:铁钉中含有碳、铁,将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,碳、铁和氯化钠溶液构成原电池而发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应.
解答:解:铁钉中含有碳、铁,将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,碳、铁和氯化钠溶液构成原电池而发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应.试管中铁钉发生反应电极反应式分别为:负极 Fe-2e-═Fe 2+,正极 O2+2H2O+4e-═4OH-,生铁遇到氯化钠溶液发生吸氧腐蚀,导致I试管中气体压强减小,小于大气压,所以II试管中的导管内水柱上升.
故答案为:Fe-2e-═Fe 2+;O2+2H2O+4e-═4OH-.
故答案为:Fe-2e-═Fe 2+;O2+2H2O+4e-═4OH-.
点评:本题考查学生金属腐蚀的原理以及原电池的工作原理知识,属于教材知识的考查,难度不大.

练习册系列答案
相关题目
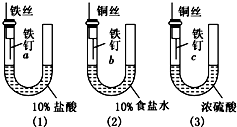 为了探究金属腐蚀的条件,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A、实验结束时,装置(1)左侧的液面一定会下降 | B、装置(2)中铁钉b发生电化学腐蚀 | C、实验结束时,装置(2)左边液面比右边高 | D、实验结束时,铁钉c腐蚀最严重 |
 如图实验为研究金属腐蚀的实验.下列相关说法正确的是( )
如图实验为研究金属腐蚀的实验.下列相关说法正确的是( ) 为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描述不正确的是( )
为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描述不正确的是( )