题目内容
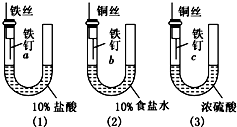 为了探究金属腐蚀的条件,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A、实验结束时,装置(1)左侧的液面一定会下降 | B、装置(2)中铁钉b发生电化学腐蚀 | C、实验结束时,装置(2)左边液面比右边高 | D、实验结束时,铁钉c腐蚀最严重 |
分析:(1)中,因盐酸易挥发,则铁与盐酸反应生成氢气;
(2)中,铁、铜形成原电池反应,发生吸氧腐蚀;
(3)中,浓硫酸具有吸水性,铁钉不易腐蚀,以此解答该题.
(2)中,铁、铜形成原电池反应,发生吸氧腐蚀;
(3)中,浓硫酸具有吸水性,铁钉不易腐蚀,以此解答该题.
解答:解:A.装置(1)中,因盐酸易挥发,则铁与盐酸反应生成氢气,则压强增大,左侧的液面一定会下降,故A正确;
B.装置(2)中,铁、铜形成原电池反应,发生吸氧腐蚀,故B正确;
C.装置(2)中发生吸氧腐蚀,压强减小,则左边液面比右边高,故C正确;
D.装置(3)中,浓硫酸具有吸水性,铁钉不易腐蚀,故D错误.
故选D.
B.装置(2)中,铁、铜形成原电池反应,发生吸氧腐蚀,故B正确;
C.装置(2)中发生吸氧腐蚀,压强减小,则左边液面比右边高,故C正确;
D.装置(3)中,浓硫酸具有吸水性,铁钉不易腐蚀,故D错误.
故选D.
点评:本题考查了金属的电化腐蚀和防护的原理分析判断,为高频考点,侧重于学生的分析能力的考查,注意原电池原理的掌握是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是 ;
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。
|
|
① FeSO4还原Cr2O72-的离子方程式为 。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为 。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
④ 下列关于铬及其化合物的说法中正确的是 。
a.K2Cr2O7是一种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
d.金属铬硬度大、耐腐蚀,是常用的镀层金属
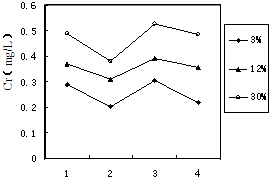
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:


我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得出多个结论:
① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可): ; 。
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.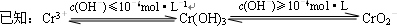 ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准. ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______. ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______.