题目内容
取pH均为2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03gZn粉,在相同条件下充分反应,有关叙述正确的是( )
| A、醋酸与锌反应放出的H2多 |
| B、盐酸与醋酸分别与锌反应放出的H2一样多 |
| C、醋酸与锌反应速率大 |
| D、盐酸与醋酸分别与锌反应的速率一样大 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:n(Zn)=
=0.0005mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.0005mol×2=0.001mol,pH=2、100mL盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸恰好反应,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以pH=2的100mL醋酸中醋酸的物质的量大于盐酸,
A.酸过量或恰好反应时,生成氢气的量与锌的质量成正比;
B.酸过量或恰好反应时,生成氢气的量与锌的质量成正比;
C.反应速率与氢离子浓度成正比;
D.反应速率与氢离子浓度成正比.
| 0.03g |
| 65g/mol |
A.酸过量或恰好反应时,生成氢气的量与锌的质量成正比;
B.酸过量或恰好反应时,生成氢气的量与锌的质量成正比;
C.反应速率与氢离子浓度成正比;
D.反应速率与氢离子浓度成正比.
解答:
解:n(Zn)=
=0.0005mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.0005mol×2=0.001mol,pH=2、100mL盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸恰好反应,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以pH=2的100mL醋酸中醋酸的物质的量大于盐酸,
A.醋酸过量、盐酸恰好反应,所以生成氢气的量与锌的质量成正比,两种溶液中锌的质量相等,所以放出的氢气一样多,故A错误;
B.根据A知,两种溶液中放出氢气一样多,故B正确;
C.醋酸是弱电解质,反应过程中醋酸不断电离出氢离子,导致反应过程中醋酸中的氢离子浓度大于盐酸,则醋酸反应速率大于盐酸,故C正确;
D.根据C的分析,醋酸反应速率大于盐酸,故D错误;
故选BC.
| 0.03g |
| 65g/mol |
A.醋酸过量、盐酸恰好反应,所以生成氢气的量与锌的质量成正比,两种溶液中锌的质量相等,所以放出的氢气一样多,故A错误;
B.根据A知,两种溶液中放出氢气一样多,故B正确;
C.醋酸是弱电解质,反应过程中醋酸不断电离出氢离子,导致反应过程中醋酸中的氢离子浓度大于盐酸,则醋酸反应速率大于盐酸,故C正确;
D.根据C的分析,醋酸反应速率大于盐酸,故D错误;
故选BC.
点评:本题考查了弱电解质的电离,首先根据酸、金属的量进行过量计算,然后根据弱电解质的电离特点来分析解答,很多同学往往不进行过量计算导致错误,为易错点.

练习册系列答案
相关题目
有M、N、P、Z四种金属,请根据以下实验:①M+N2+=M2++N;②用Pt电极电解相同物质的量浓度的P和M的硫酸盐的混合溶液,在阴极上先析出单质M;③把N和Z用导线相连并同时放入Z的硫酸盐溶液中,电极反应为:Z2++2e-=Z,N-2e-=N2+,判断这四种金属的还原性由强到弱的正确顺序是( )
| A、M>N>P>Z |
| B、M>N>Z>P |
| C、Z>P>M>N |
| D、P>M>N>Z |
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+ 分别加入H2O中,基本上不影响水的电离平衡的是( )
| A、①③⑤⑦⑧ | B、②④⑦ |
| C、①⑥ | D、②④⑥⑧ |
下列说法不正确的是( )
| A、热的纯碱去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污能力增强 | ||||
| B、铁在潮湿的环境下生锈与盐类水解有关 | ||||
| C、将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3 | ||||
D、将FeCl3饱和溶液滴入沸水中制胶体,离子方程式为Fe3++3H2O
|
铅蓄电池是常用的直流电源,下列关于如图所示装置的说法中,正确的是( )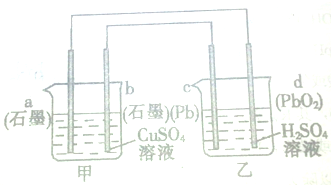

| A、电极b为阳极 |
| B、电极a上发生的反应为Cu2++2e-═Cu |
| C、工作时,装置甲中溶液的pH减小 |
| D、外电路中电子流动方向为由b经导线到c |