题目内容
14.下列各组物质的性质比较中,不正确的是( )| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:KOH>NaOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I->Br ->Cl- |
分析 A.非金属性越强,对应氢化物的稳定性越稳定;
B.金属性越强,对应碱的碱性越强;
C.同主族从上到下非金属性减弱,非金属性越强,对应最高价含氧酸的酸性越强;
D.同主族从上到下非金属性减弱,非金属性越强,对应阴离子的还原性越弱.
解答 解:A.非金属性O>S,对应氢化物的稳定性为H2S<H2O,故A错误;
B.金属性K>Na>Mg,对应碱的碱性为KOH>NaOH>Mg(OH)2,故B正确;
C.同主族从上到下非金属性减弱,非金属性越强,非金属性为Cl>Br>I,对应最高价含氧酸的酸性为HClO4>HBrO4>HIO4,故C正确;
D.同主族从上到下非金属性减弱,非金属性为Cl>Br>I,对应阴离子的还原性为I->Br ->Cl-,故D正确;
故选A.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
5.下列实验中,为实现实验目的,除杂操作正确的是( )
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
9.下列各组物质中,按熔点由低到高排列正确的是( )
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | C. | Na、K、Rb | D. | SiC、NaCl、SO2 |
17.下列有关化学键的叙述,正确是的( )
| A. | 共价化合物中可以含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物可能是共价化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
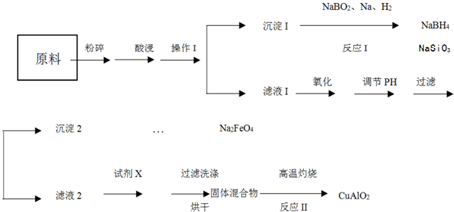
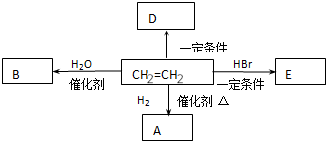
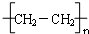 .
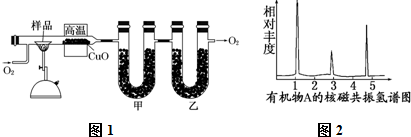
.
 .
. .
.