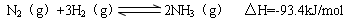题目内容
T°C时,将体积为VAL、浓度为a mol/L的一元酸HA与体积为VBL、浓度为b mol/L的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是
- A.混合液的pH=7
- B.a=b
- C.混合液中Kw=[c(H+)]2
- D.a=b,VA=VB
C
“混合液恰好呈中性”说明c(H+)= c(OH-),则Kw= c(H+)×c(OH-)=[c(H+)]2,故C正确;25°C时的中性溶液pH=7,但题中是在T°C,故A错误;
一元酸HA与一元碱BOH恰好中和,即VA×a=VB×b,但B、D不一定正确
“混合液恰好呈中性”说明c(H+)= c(OH-),则Kw= c(H+)×c(OH-)=[c(H+)]2,故C正确;25°C时的中性溶液pH=7,但题中是在T°C,故A错误;
一元酸HA与一元碱BOH恰好中和,即VA×a=VB×b,但B、D不一定正确

练习册系列答案
相关题目
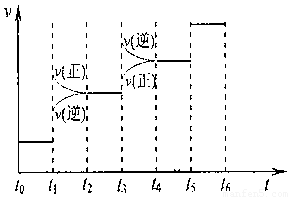
(10分)25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(m ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
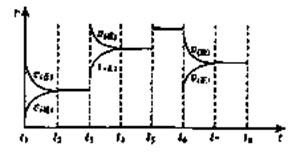
(3)下图表示此反应的反应速率v和时间t的关系图: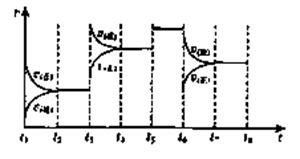
各阶段的平衡常数如下表所示:
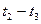 | 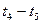 |  |  |
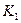 |  | 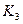 | 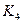 |


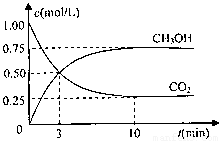
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol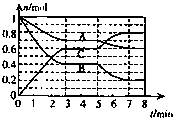
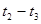
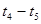
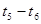

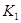
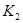
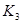
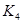
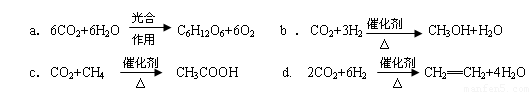
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol