题目内容
2.某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:实验(一):热稳定性
利用如图装置进行实验,加热A中Fe(NO3)3固体,A和B中都有红棕色气体产生,A试管中生成了红色粉末.

(1)B装置的作用是防倒吸;检验A中红色固体Fe2O3,所用的试剂是HCl、KSCN(填化学式).
(2)加热A中试管一段时间后,C中导管口有气泡产生,而集气瓶中无气泡产生原因是NO2、O2恰好与氢氧化钠溶液完全反应.
(3)写出硝酸铁受热分解的化学方程式4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+12NO2↑+3O2↑.
实验(二):氧化性Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.该小组设计如下实验:
| 试验编号 | 实验操作 | 现象 |
| a | 向10mL 3mol•L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
| b | 向10mL 3mol•L-1AgNO3溶液中滴加2mL 0.1mol•L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
| c | 向10mL 3mol•L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(5)实验b涉及反应的离子方程式为Fe2++Ag+?Fe3++Ag.
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的浓度有关.
分析 (1)B装置中导气管略露出胶塞起到防倒吸作用;检验A中红色固体Fe2O3,需要先加入酸溶解后用KSCN检验铁离子的存在;
(2)加热A中Fe(NO3)3固体,A和B中都有红棕色气体产生为NO2,加热A中试管一段时间后,C中导管口有气泡产生,而集气瓶中无气泡产生说明分解反应
生成的气体中含有氧气,且二氧化氮和氧气按照4:1恰好溶于水生成硝酸和氢氧化钠完全反应;
(3)硝酸铁受热分解生成氧化铁、二氧化氮和氧气,结合电子守恒和原子守恒配平书写化学方程式;
(4)利用实验a验证硝酸根离子在酸性溶液中和银不发生反应;有白色沉淀生成,生成是氯化钠和硝酸银生成的氯化银白色沉淀,证明铁离子氧化银单质生成银离子;
(5)向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液,紫红色不褪去说明溶液中无亚铁离子,说明亚铁离子和银离子发生反应生成铁离子和银;
(6)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
解答 解:(1)B装置的作用是防倒吸,检验A中红色固体Fe2O3,所用的试剂是HCl、KSCN,先加入盐酸溶解得到溶液中滴入KSCN溶液生成血红色证明铁离子存在,
故答案为:防倒吸;HCl、KSCN;
(2)加热A中Fe(NO3)3固体,A和B中都有红棕色气体产生为NO2,加热A中试管一段时间后,C中导管口有气泡产生,而集气瓶中无气泡产生说明分解反应
生成的气体中含有氧气,且二氧化氮和氧气按照4:1恰好溶于水生成硝酸和氢氧化钠完全反应,
故答案为:NO2、O2恰好与氢氧化钠溶液完全反应;
(3)硝酸铁受热分解生成氧化铁、二氧化氮和氧气,生成的二氧化氮和氧气按照4:1生成,据此配平书写得到化学方程式为:4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+12NO2↑+3O2↑,
故答案为:4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+12NO2↑+3O2↑;
(4)利用实验①验证硝酸根离子在酸性溶液中和银不发生反应,设计实验①的目的是排除NO3-的干扰,)向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液,有白色沉淀生成,生成是氯化钠和硝酸银生成的氯化银白色沉淀,证明铁离子氧化银单质生成银离子,说明Fe3+能氧化Ag,
故答案为:排除NO3-的干扰;Fe3+能氧化Ag;
(5)向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液,紫红色不褪去说明溶液中无亚铁离子,说明亚铁离子和银离子发生反应生成铁离子和银,反应的离子方程式为:Fe2++Ag+?Fe3++Ag,
故答案为:Fe2++Ag+?Fe3++Ag;
(6)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关,
故答案为:浓度.
点评 本题考查了物质组成和成分的实验探究方法和过程分析判断,主要是物质性质和反应现象的理解应用,掌握基础是解题关键,题目难度中等.

| A. | C | B. | P | C. | O | D. | S |
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-=CO32-+H2O |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S=2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-=CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | H、D、T互为同素异形体 | B. | 质量数为31的磷原子:${\;}_{15}^{31}$P | ||
| C. | 次氯酸的电子式: | D. | 乙烯的结构简式是:CH2CH2 |
| A. | NH4+、Mg2+、NO3-、Cl- | B. | Cu2+、Na+、HCO3-、Br- | ||
| C. | Na+、Fe2+、SO42-、NO3- | D. | K+、Na+、AlO2-、Cl- |

已知:
①2NO+Na2O2═2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色.
(1)实验装置的连接顺序为A C E D E B;
(2)C瓶内发生反应的离子方程式为Cu+2H++NO2=Cu2++NO↑+H2O.
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,实验所得数据如表.
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时俯视读数
d.滴定结束,滴定管尖嘴端悬挂一滴液体
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为86.25%.
(4)设计实验,比较0.1mol•L-1NaNO2溶液中NO2-的水解程度和0.1mol•L-1HNO2溶液中HNO2电离程度的相对大小25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度,若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(简要说明实验步骤、现象和结论,仪器和药品自选).
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | |
| C. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 同主族金属元素从上到下,最高价氧化物对应水化物酸性减弱 |
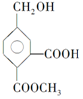 ,它在一定条件下可发生的反应为( )
,它在一定条件下可发生的反应为( )①酯化反应 ②氧化反应 ③加聚反应 ④取代反应.
| A. | ①②④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
