题目内容
在有催化剂存在的体积可变容器中,保持恒温恒压下,进行如下反应:N2+3H2
| 起始状态物质的量/mol | 平衡时HN3的物质的量/mol | ||
N2 | H2 | NH3 | ||
已知 | 1 | 4 | 0 | a |
① | 1.5 | 6 | 0 |
|
② |
|
| 1 | 0.5a |
③ | m | n |
|
|
解析:由于起始n(N2)∶n(H2)=1∶4,则当起始以1 mol NH3通入时,达到相同的平衡状态时,须通入0.5 mol的H2;若起始通入m mol N2和n mol H2,并通入x mol NH3,则有:
N2 + 3H2 ![]() 2NH3
2NH3
①起始: 1 4 0
平衡: ![]() 4-
4-![]() a a
a a
转化: ![]()
![]() x x
x x
②起始:(m+![]() )∶(n+
)∶(n+![]() x)=1∶4,
x)=1∶4,
所以x=2(n-4m)。
由于平衡时n(NH3)∶n始(N2)=a∶1,
则③平衡时n(NH3)∶[m+(n-4m)]=a∶1,
n(NH3)=a(n-3m)。
答案:①1.5a ②0 0.5 ③2(n-4m) (n-3m)a

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
在有催化剂存在的体积可变容器中,保持恒温恒压下,进行如下反应: N2+3H2![]() 2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空:
2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空:
|
|
起始状态物质的量/(mol) |
平衡时NH3的物质的量/(mol) |
||
|
N2 |
H2 |
NH3 |
||
|
已知 |
1 |
4 |
0 |
a |
|
① |
1.5 |
6 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
N |
|
|
在有催化剂存在的体积可变容器中,保持恒温恒压下,进行如下反应: N2+3H2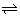 2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空:
2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3。在相同条件下,保持平衡时各组分的百分含量不变,对①~③状态填空:
|
|
起始状态物质的量/(mol) |
平衡时NH3的物质的量/(mol) |
||
|
N2 |
H2 |
NH3 |
||
|
已知 |
1 |
4 |
0 |
a |
|
① |
1.5 |
6 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
N |
|
|