题目内容
【题目】粗铜精炼后的阳极泥中含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的工艺流程如图所示:
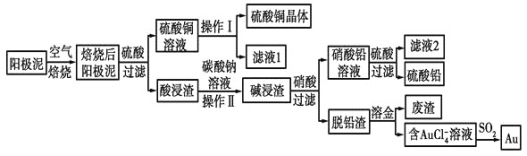
(1)电解精炼含铜、金、铅的粗铜时,电解液应该用________溶液作电解液,电解时阳极的电极反应式为___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步骤有:__________________,过滤,洗涤,干燥。
(3)写出用SO2还原AuCl4-的离子反应方程式____________________________。
(4)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法________________________。
(5)用离子方程式表示加入碳酸钠溶液的作用:___________________________。[已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。当溶液中c(SO42-)=0.2mol/L时,c(CO32-)=________mol/L。![]() 结果保留2位有效数字
结果保留2位有效数字![]()
【答案】CuSO4 Pb-2e-+SO42-=PbSO4 蒸发浓缩,降温结晶 2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+ 用滤液2溶解碱浸渣(或并入硝酸中溶解碱浸渣) PbSO4(s)+CO32-(aq)PbCO3(s)+SO42-(aq) 1.6×10-6
【解析】
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤,干燥获得硫酸铜晶体;Au(金)和PbSO4等杂质经碳酸钠浸洗、浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au。
(1)电解精炼粗铜时一般用硫酸铜溶液作电解质溶液;电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活泼性比Cu强的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为:Pb-2e-+SO42-=PbSO4;
(2)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,操作II是从酸浸渣(PbSO4)中得到碱浸渣(PbCO3),因此该操作是过滤操作;
(3)SO2还原AuCl4-中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42-,还原产物是Au,根据氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,因此得到的反应方程式为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
(4)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,因此类似此处的做法,应该是流程中得到的另一滤液2,此滤液2是在硝酸铅溶液中加入硫酸生成硫酸铅沉淀并过滤出硫酸铅后剩下的溶液,此溶液中H+没有发生反应,因此还有大量的硝酸溶液,所以可以把此滤液当成硝酸加入前面的碱浸渣中溶解碱浸渣;
(5)通过比较两种沉淀的溶度积,可以看出碳酸铅比硫酸铅更加难溶,因此往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应,离子方程式要注意标明状态,方程式为:PbSO4(s)+CO32-(aq)PbCO3(s)+SO42-(aq),已知298K时,当溶液中c(SO42-)=0.2mol/L,Ksp(PbSO4)=1.82×10-8时,c(Pb2+)=9.1×10-8mol/L,Ksp(PbCO3)=1.46×10-13,c(CO32-)=1.6×10-6mol/L。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案