题目内容
【题目】Ⅰ、工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产过程中会产生沉淀氢氧化铁,用来制取FeCO3的流程如下:
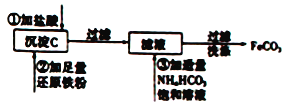
完成上述转化过程中的离子方程式
①____________________________。
②____________________________。
Ⅱ、有一瓶澄清溶液,其中可能含有可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-。取该溶液进行以下实验:
(1)填写表中开空白:
实验步骤 | 肯定不存在的离子 |
①用PH试纸检验,溶液呈强酸性 | |
②取出部分溶液,加入少量CCl4和数滴新制氯水,振荡,精置CCl4层呈紫红色 | |
③另取出部分溶液,向其加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成 |
(2)根据以上事实,该溶液中肯定存在的离子是_________________。
【答案】Ⅰ.①Fe(OH)3+3H+=Fe3++3H2O②Fe2++2HCO3-=FeCO3↓+CO2+H2O
II.(1)①CO32-②Fe3+、NO3-、③Mg2+、Al3+④无⑤SO42-(2)I-、NH4+、Ba2+
【解析】
试题分析:Ⅰ.氢氧化铁沉淀溶解在盐酸中生成氯化铁和水,离子方程式为Fe(OH)3+3H+=Fe3++3H2O;过滤后滤液中含有亚铁离子,与碳酸氢根反应生成碳酸亚铁,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2 +H2O;
II. 试题分析:①溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存,说明溶液中肯定不含有CO32-;
②根据实验现象:CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而I-与Fe3+、NO3-和H+能发生氧化还原反应,而不能共存,说明溶液中肯定不含有Fe3+、NO3-;
③根据实验现象:溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Fe3+、Mg2+、Al3+;
④根据实验现象:取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-;
⑤由上述实验事实确定,该溶液中肯定存在的离子是:Ba2+、I-、NH4+;肯定不存在的离子是:Mg2+、Fe3+、Al3+、NO3-、Fe3+、CO32-、SO42-;还不能确定是否存在的离子是:K+、Na+、Cl-,故答案为:Ba2+、I-、NH4+;K+、Na+、Cl-。

【题目】氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解。
(1)已知:
化学键 | 断开1mol化学键所需的能量(kJ) |
H-H | 436 |
O-H | 463 |
O=O | 498 |
①H2O的电子式是________________。
②H2O(g)分解的热化学方程式是________________________。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出__________kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 | |
a | 50 mL5%H2O2溶液 | 1 mL0.1 mol·L-1FeCl3溶液 | |
b | 50 mL5%H2O2溶液 | 少量浓盐酸 | 1 mL0.1 mol·L-1FeCl3溶液 |
c | 50 mL5%H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
d | 50 mL5%H2O2溶液 | MnO2 | |
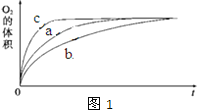
① 测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。由该图能够得出的实验结论是______________________。
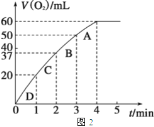
② 测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因________________;计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。