题目内容
【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应,也不与氢氧化钠反应),实验步骤如下:
①配制![]() 稀盐酸和
稀盐酸和![]() 溶液各
溶液各![]()
②取一粒药片(![]() )研碎后加入
)研碎后加入![]() 蒸馏水
蒸馏水
③加入![]() 稀盐酸
稀盐酸
④用![]() 溶液中和过量盐酸,用去体积为
溶液中和过量盐酸,用去体积为![]() 。
。
请回答下列问题:
(1)测定过程中发生反应的离子方程式_________。
(2)配制上述![]() 稀盐酸所用玻璃仪器有量筒、烧杯、________。
稀盐酸所用玻璃仪器有量筒、烧杯、________。
(3)如果选用酚酞作指示剂,滴定达到终点的现象为____。
(4)某同学四次测定的![]() 数据如下:
数据如下:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 13.40 | 11.90 | 12.10 | 12.00 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数为_____。
(5)若在实验过程中存在下列操作,会使所测碳酸钙的质量分数偏高的是_________。
a 用没有润洗的碱式滴定管装![]() 溶液进行滴定
溶液进行滴定
b 用没有润洗的酸式滴定管量取![]() 稀盐酸溶解样品
稀盐酸溶解样品
c 用![]() 溶液滴定时,开始读数平视,终点俯视
溶液滴定时,开始读数平视,终点俯视
d 装![]() 溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
【答案】CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O 玻璃棒、胶头滴管、250mL容量瓶 当最后一滴NaOH溶液滴下,溶液由无色变为淡红色,且半分钟内不褪色 65.0% bc
【解析】
(1)测定过程中发生的反应有:药片中的碳酸钙与盐酸的反应、盐酸与氢氧化钠溶液的反应,据此书写反应的离子方程式;
(2)根据配制溶液的一般步骤分析解答;
(3)选用酚酞作指示剂,滴定终点时溶液变为粉红色,据此解答;
(4)第一次数据误差大,需要舍去,然后计算消耗NaOH的平均体积,结合反应的原理计算;
(5)中和反应过程中消耗NaOH的体积越小,碳酸钙消耗的盐酸就越多,碳酸钙的质量分数就越高,据此分析判断。
(1)测定过程中发生的反应有:药片中的碳酸钙与盐酸的反应、盐酸与氢氧化钠溶液的反应,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O;
(2)配制250mL0.100mol/L稀盐酸所用玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、250mL容量瓶,故答案为:玻璃棒、胶头滴管、250mL容量瓶;
(3)用NaOH溶液滴定盐酸,选用酚酞作指示剂,酚酞在盐酸中无色,因此滴定终点的现象为:溶液由无色变为浅红色,半分钟内不褪色,故答案为:当最后一滴NaOH溶液滴下,溶液由无色恰好变淡红色,且半分钟内不褪色;
(4)第一次数据误差较大,应该省去,所以每片药剂平均耗NaOH溶液体积为![]() =12.00mL,与CaCO3反应的盐酸的体积为:25.00mL-12.00mL=13.00mL,则每片药剂中CaCO3的质量分数为
=12.00mL,与CaCO3反应的盐酸的体积为:25.00mL-12.00mL=13.00mL,则每片药剂中CaCO3的质量分数为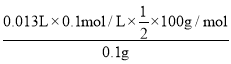 ×100%=65.0%,故答案为:65.0%;
×100%=65.0%,故答案为:65.0%;
(6)a.没有润洗就装氢氧化钠溶液进行滴定,则氢氧化钠溶液被稀释,滴定时造成V(碱)偏大,根据V(酸)=![]() 可知,V(酸)偏大,则与CaCO3反应的盐酸的体积偏小,引起测量结果偏低,故a不选;b.没有润洗就装HCl溶液进行滴定,则HCl被稀释,盐酸的浓度偏小,则与CaCO3反应的盐酸的体积偏大,引起测量结果偏高,故b选;c.用氢氧化钠溶液滴定时,开始平视,终点俯视,造成V(碱)偏小,根据V(酸)=
可知,V(酸)偏大,则与CaCO3反应的盐酸的体积偏小,引起测量结果偏低,故a不选;b.没有润洗就装HCl溶液进行滴定,则HCl被稀释,盐酸的浓度偏小,则与CaCO3反应的盐酸的体积偏大,引起测量结果偏高,故b选;c.用氢氧化钠溶液滴定时,开始平视,终点俯视,造成V(碱)偏小,根据V(酸)=![]() 可知,V(酸)偏小,则与CaCO3反应的盐酸的体积偏大,引起测量结果偏高,故c选;d.装NaOH溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡,造成V(碱)偏大,根据V(酸)=
可知,V(酸)偏小,则与CaCO3反应的盐酸的体积偏大,引起测量结果偏高,故c选;d.装NaOH溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡,造成V(碱)偏大,根据V(酸)=![]() 可知,V(酸)偏大,则与CaCO3反应的盐酸的体积偏小,引起测量结果偏低,故d不选;故答案为:bc。
可知,V(酸)偏大,则与CaCO3反应的盐酸的体积偏小,引起测量结果偏低,故d不选;故答案为:bc。