题目内容
16.五种短周期的元素X、Y、Z、W、M的原子序数依次增大,元素X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,M的最高正价与最低负价的绝对值之差为4,五种元素原子的最外层电子数之和为19.下列说法正确的是( )| A. | W的最高价氧化物能与水反应生成相应的酸 | |
| B. | 室温下,0.05mol•L-1的M的气态氢化物的水溶液的PH>l | |
| C. | 简单离子半径由大到小的顺序:Y>Z>M | |
| D. | Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Z电极上产生大量气泡 |
分析 五种短周期的元素X、Y、Z、W、M的原子序数依次增大,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,可知Z为Al;W原子的最外层电子数是次外层电子数的一半,由原子序数可知W为第三周期元素,则W的最外层电子数为4,W为Si元素;元素X与W位于同一主族,X为C元素;M的最高正价与最低负价的绝对值之差为4,M为S元素;五种元素原子的最外层电子数之和为19,则Y的最外层电子数为19-4-4-3-6=2,则Y为Mg元素,以此来解答.
解答 解:由上述分析可知,X为C,Y为Mg,Z为Zl,W为Si,M为S,
A.W的最高价氧化物为二氧化硅,不能与水反应,故A错误;
B.M的气态氢化物为H2S,为弱酸,室温下0.05mol•L-1的H2S水溶液中电离出氢离子小于0.1mol/L,则溶液的pH>l,故B正确;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径由大到小的顺序:M>Y>Z,故C错误;
D.Al与NaOH反应,而Mg不能,则Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Y电极上产生大量气泡,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、原子结构来推断元素为解答的关键,侧重分析与推断能力的考查,注意Z为Al为推断的突破口,选项D为易错点,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 石油液化气的主要成份为甲烷 | |
| B. | 燃料的脱硫、脱氮都是减少酸雨产生的措施 | |
| C. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
7.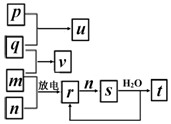 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )| A. | Y、W的最高价氧化物对应的水化物均为强酸 | |
| B. | 元素的非金属性:Z>Y>X,原子半径:X<Z<Y | |
| C. | s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2 | |
| D. | v的电子式可表示为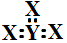 |
4.有X、Y、Z三种原子序数逐渐增大的主族元素,它们分别处于不同短周期,其中Y是自然界中形成化合物种类最多的元素,Z元素在地壳中的含量是同周期主族元素中最高的.则下列说法错误的是( )
| A. | X与其它元素之间只能形成共价键 | |
| B. | Z元素的最高价氧化物是玻璃的主要成分,其常温下就能与强碱发生反应 | |
| C. | 非金属性Y强于Z | |
| D. | 三种元素中X的原子半径最小 |
11.下列示意图与对应的化学反应关系不一致的是( )
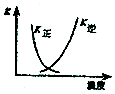 A.2SO2(g)+O2(g)?2SO3(g)△H<0 |  B.25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液 |
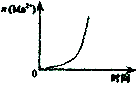 C.酸性KmnO4溶于与过量的H2C2O4溶液混合 |  D.CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,使用催化剂(a)和未使用催化剂(b) |
| A. | A | B. | B | C. | C | D. | D |
1. X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
 X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为l:2的化合物 | |
| C. | X、Y、Z元素形成的化合物溶于水中,对水的电离平衡一定起抑制作用 | |
| D. | R和M的化学键类型和晶体类型都相同. |
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y是地壳中含量最高的元素,W的原子序数是Y的2倍,X、Y、Z、W最外层电子数之和为19.下列说法正确的是( )
| A. | X和Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)>r(W)>r(Y) | |
| C. | W的简单气态氢化物的热稳定性比Y强 | |
| D. | 元素Z、W的简单离子具有相同的电子层结构 |
14.下列各微粒中,与SO42-互为等电子体的是( )
| A. | NO3- | B. | SO32- | C. | PO43- | D. | CO32- |
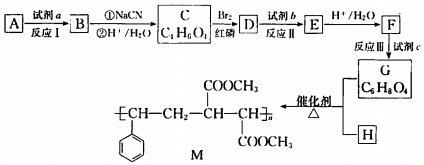
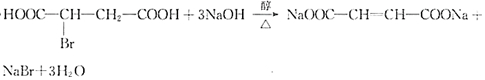 .
.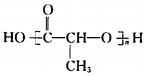 在该条件下,1mol N生成2mol I,N的结构简式是
在该条件下,1mol N生成2mol I,N的结构简式是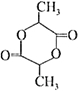 .
.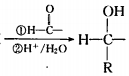 以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):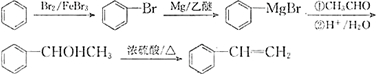 .
.