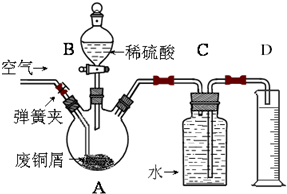
题目内容
利用下图所示装置收集以下8种气体(图中烧瓶的位置不得变化).
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2

(1)若烧瓶是干燥的,则由B口进气可收集的气体有________(写序号);
(2)若烧瓶充满水,可收集的气体有________,这时气体由________口进入;
(3)若烧瓶是干燥的,则由A口进气,可收集的气体有________;
(4)若在烧瓶内装入浓硫酸进行气体干燥,则可用此装置干燥的气体有________,这时气体由________口进入.
解析:
|
由上图可以看出: (1)若烧瓶是干燥的,由B口进气收集的气体必然为比空气重的气体.这是因为只有比空气重的气体如Cl2、HCl、H2S、SO2等,当由B口进气后,才能在烧瓶底部逐渐积聚,产生的压强将瓶内的空气由A口排出,直至所收集的气体充满整个烧瓶. (2)若烧瓶充满水,则应为能够采用排水集气法收集的气体,装置应与“排水量气”装置相同,遵循“短进长出”的原则.此时由A口通入像H2、CH4、NO等极难溶于水的气体,气体产生的压强将烧瓶中的水由B口排出,当烧瓶中的水排尽后,即说明烧瓶内已充满所收集的气体. (3)若烧瓶是干燥的,由A口进气可收集的气体应为比空气轻的气体.这是因为只有比空气轻的气体如H2、CH4、NH3等,当由A口进气后,才必然由烧瓶最上方逐渐积聚,产生的压强将瓶内空气由B管排出,直到所收集的气体充满整个烧瓶. (4)浓硫酸为强氧化性的酸性干燥剂,其干燥气体的范围为非还原性的中性及酸性气体.进行干燥时,气体的流向应遵循“长进短出”的原则,所以除NH3(为碱性气体)、H2S(为还原性气体,易被浓硫酸氧化)外,其余气体均可由浓硫酸干燥. 综上所述,本题的正确答案:(1)②④⑦⑧;(2)①③⑥,A;(3)①③⑤;(4)①②③④⑥⑧,B. |
提示:
|
解析: 本题考查的内容很基本,但综合思考性较强.其立意在于考查学生对常见实验装置图的识别、分析能力;运用正确的化学实验基本操作等知识;通过思维的联想、迁移和重组,解决具体问题的能力.就本题而言,要求学生在平时学习中,不仅要牢记常见气体的发生、干燥和收集的操作方法,而且要特别注意掌握其规律性. |