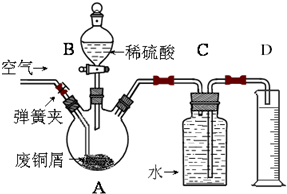
题目内容
利用下图所示装置收集以下8种气体(图中烧瓶位置不得变化):


(1)若烧瓶是干燥的,则由y口进气可收集的气体有________;改由x口进气,可收集的气体有________.
(2)若烧瓶充满水,通常可收集的气体有________,这时气体由________口进入.
(3)若烧瓶内装入浓硫酸用于干燥气体,则可用此装置来干燥的气体有________,这时气体由________进入.
答案:
解析:
解析:
|
(1)②,④,⑦,⑧,①,③,⑤ (2)①,③,⑥,x (3)①,②,③,④,⑥,⑧,y |

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目