题目内容
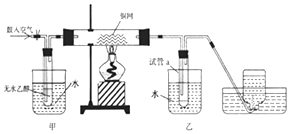
【题目】(1)图Ⅰ是实验室用H2还原CuO实验的简易装置,其中的铜质燃烧匙可以在试管中上下移动,虚线框中需从图Ⅱ中选取装置。图Ⅱ中的细铜丝一端被弯成螺旋状,实验时,先在酒精灯火焰上加热,变黑后再迅速伸入制得的H2中。
①在图Ⅰ中,X溶液应选用______。
A.稀硫酸 B.浓硫酸 C.NaCl溶液
②在图Ⅰ虚线框中,应选用图Ⅱ中的_______(填A或B)装置。
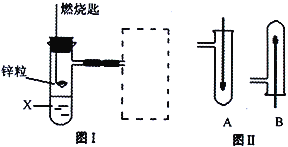
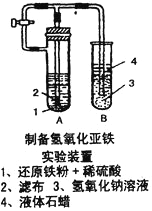
(2)某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见上右图,请分析实验过程:
①在B试管中加入NaOH溶液后加热煮沸l-2分钟并立即加入2mL液体石蜡,上述操作中加热煮沸的目的是:_____________________________。
②在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉要过量_____________。
③连接好导管,同时打开活栓,当铁粉与稀硫酸反应平稳时,关闭活栓,这时看到A试管中_________(填现象),B试管中_________(填现象)。
④如果B中产生的氢氧化亚铁遇到空气,出现的现象是_______________,发生变化的化学方程式为_____________。
(3)现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。
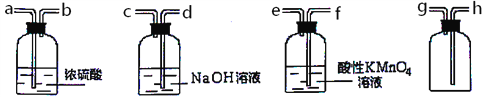
①要达到实验目的,按气流从左到右,各接口连接顺序正确的是_______。
A.dcabh B.feabh C.feabg
②本实验除去SO2的原理是利用SO2的________性质(填序号)。
A.氧化性 B.漂白性 C.还原性 D.酸性
③SO2与酸性高锰酸钾反应的离子方程式是__________________。
【答案】 A B 为了驱除溶在NaOH溶液中的氧气 保证溶液中不存在Fe3+ 溶液经导管压入B试管中 产生白色沉淀 白色迅速变为灰绿色、最后变为红褐色 4Fe(OH)2+O2+2H2O==4Fe(OH)3 B C 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
【解析】(1)①由题意知,X可与锌粒反应产生氢气,所以在图Ⅰ中,X溶液应选用稀硫酸,填A。②因为氢气的密度比空气小,所以在图Ⅰ虚线框中,应选用图Ⅱ中的B装置。
(2)某学生设计了一个制取氢氧化亚铁的实验方案,由实验装置可知,该实验的原理是先制取氢气,并打开活塞,用氢气排出系统内的空气,然后关闭活塞,利用产生的氢气排出部分硫酸亚铁溶液进入B管中,与氢氧化钠反应制备氢氧化亚铁。①在B试管中加入NaOH溶液后加热煮沸l-2分钟并立即加入2mL液体石蜡,上述操作中加热煮沸的目的是为了驱除溶在NaOH溶液中的氧气。②在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,过量的铁粉是为了保证溶液中不存在Fe3+。③连接好导管,同时打开活栓,当铁粉与稀硫酸反应平稳时,关闭活栓,这时看到A试管中溶液经导管压入B试管中,B试管中产生白色沉淀。
④如果B中产生的氢氧化亚铁遇到空气,出现的现象是白色迅速变为灰绿色、最后变为红褐色,发生变化的化学方程式为4Fe(OH)2+O2+2H2O==4Fe(OH)3。
(3)根据题中所给装置,应将混有少量SO2杂质的CO2气体通过酸性高锰酸钾溶液除去二氧化硫,然后用浓硫酸干燥,最后用向上排空气法收集到干燥的二氧化碳。
①要达到实验目的,按气流从左到右,各接口连接顺序正确的是feabh ,选B。
②本实验除去SO2的原理是利用SO2的还原性,选C。
③SO2与酸性高锰酸钾反应的离子方程式是5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。

【题目】实验室用少量的溴水和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示: 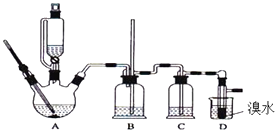
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请回答下列问题:
(1)写出制备1,2二溴乙烷的反应原理方程式:、
(2)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是(填序号).
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是 .
(4)在装置C中应加入(填序号),其目的是吸收反应中可能生成的酸性气体.
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是 .
(6)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在(填“上”或“下”)层.
(7)若产物中有少量副产物乙醚,可用的方法除去.
【题目】有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40 mL 1 mol/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化)。
实验序号 | ① | ② | ③ | ④ |
m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
下列实验结论不正确的是
A. 实验②反应后溶液中含有Fe2+、Cu2+ B. 实验②③④反应后剩余固体全部是Cu
C. 实验④的滤液中c(Fe2+)=1.5 mol/L D. 原粉末样品中n(Fe)∶n(Cu)=1∶1