题目内容
【题目】红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
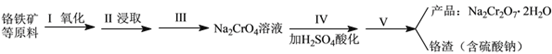
(1)步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 (g)![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0该反应的化学平衡常数的表达式为__________________________。
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0该反应的化学平衡常数的表达式为__________________________。
(2)在常温下该反应速度极慢,下列措施中能使反应速率增大的是_____________________________ 。
a.升高温度 b.及时转移生成CO2 c.将原料粉碎 d.增加纯碱的用量
(3)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是__________________________、____________________________。
(4)步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_____________________________________。
(5)步骤Ⅳ酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________。
【答案】 K = c8(CO2)/c7 (O2) a c NaA1O2 Na2SiO3 除去A1O2-、SiO32-等杂质 2CrO42-+2H+= Cr2O72-+H2O
【解析】(1). 在4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 (g)![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) 中,FeO·Cr2O3、Na2CO3、Na2CrO4、Fe2O3为固体,则该反应的化学平衡常数表达式为: K = c8(CO2)/c 7 (O2),故答案为: K = c8(CO2)/c 7 (O2);
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) 中,FeO·Cr2O3、Na2CO3、Na2CrO4、Fe2O3为固体,则该反应的化学平衡常数表达式为: K = c8(CO2)/c 7 (O2),故答案为: K = c8(CO2)/c 7 (O2);
(2). a. 升高温度,可以加快反应速率,故a正确;b. 及时转移生成的CO2,CO2的浓度减小,反应速率减慢,故b错误;c. 将原料粉碎,可以增大固体的接触面积,加快反应速率,故c正确;d. 因纯碱是固体,所以增加纯碱的用量,不能改变反应速率,故d错误;答案选ac;
(3). 铬铁矿的主要成分是FeO·Cr2O3,还含有Al2O3、SiO2等杂质,步骤Ⅱ中所得溶液显碱性,为了不引入新的杂质,说明步骤II中加入的物质是氢氧化钠,Al2O3、SiO2能和氢氧化钠反应分别生成偏铝酸钠和硅酸钠,故答案为:NaA1O2;Na2SiO3;
(4). 步骤Ⅲ需将溶液的pH调至7~8并煮沸,A1O2-、SiO32-等杂质可以生成沉淀而除去,故答案为:除去A1O2-、SiO32-等杂质;
(5). 步骤IV酸化时,CrO42-转化为Cr2O72-,该反应的离子方程式为:2CrO42-+2H+= Cr2O72-+H2O,故答案为:2CrO42-+2H+= Cr2O72-+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= , 已知:K(300℃)>K(350℃),该反应是反应(填“放热”或“吸热”).
(2)图中表示NO2的变化的曲线是 , 用O2的浓度变化表示从0~2s内该反应的平均速率v=
(3)能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.
【题目】一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2 , 发生反应:2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前2 s 的平均速率v(O2)=0.4 molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3 , 达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2 , 反应达到新平衡时n(SO3)/n(O2)增大