题目内容
11. 在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:(1)冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在abc(填序号).
a.离子键 b.极性键 c.配位键 d.范德华力
(2)CO2分子的空间构型为直线形,中心原子的杂化方式为sp,和CO2 互为等电子体的氧化物是N2O.
(3)反应物中电负性最大的元素为F(填元素符号),写出其原子最外层的电子排布图:
 .
.(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图Z164甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是Na+(填具体的微粒符号).
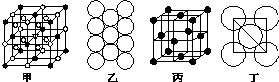
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:若已知Al的原子半径为d,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为4个;Al晶体的密度为$\frac{M}{4\sqrt{2}d{\;}^{3}N{\;}_{A}}$(用字母表示).
分析 (1)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键;
(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)元素的非金属性越强,其电负性越强,F元素电负性最大,F原子核外最外层电子排布式为2s22p5;
(4)利用均摊法计算晶胞中白色球、黑色球数目,再根据化学式判断;
(5)利用均摊法计算Al原子个数,表示出晶胞质量,面对角线上3个Al原子相邻,晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键,也属于极性键,
故选:abc;
(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体,和CO2 互为等电子体的氧化物是N2O,
故答案为:直线形;sp;N2O;
(3)元素的非金属性越强,其电负性越强,所以电负性最强的是F元素;F原子核外最外层上s、p能级,s、p能级上电子分别是2、5,其最外层轨道表示式为 ,
,
故答案为:F; ;
;
(4)●的个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=12×$\frac{1}{4}$+8=11,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,
故答案为:Na+;
(5)晶胞中Al原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量4×$\frac{M}{N{\;}_{A}}$g,面对角线上3个Al原子相邻,晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,则晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}d){\;}^{3}}$g•cm-3=$\frac{M}{4\sqrt{2}d{\;}^{3}N{\;}_{A}}$g•cm-3;
故答案为:4;$\frac{M}{4\sqrt{2}d{\;}^{3}N{\;}_{A}}$.
点评 本题考查了物质的结构与性质,涉及化学键、空间构型与杂化方式、等电子体、核外电子排布、晶胞计算等,(5)中关键是明确原子半径与晶胞棱长关系掌握均摊法进行晶胞有关计算.

(1)卤族元素位于周期表的p区
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在.使氢氟酸分子缔合的作用力是氢键
(3)请根据下表提供的第一电离能数据判断:理论上最有可能生成较稳定的单核阳离子的卤素原子是I(填名称或元素符号)
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
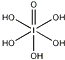 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)(5)已知ClO2-为V型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出与ClO3-互为等电子体的分子的分子式NCl3(写出1个)
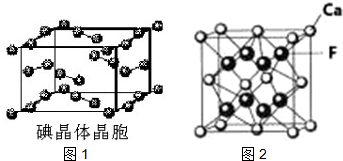
(6)如图1为碘晶体晶胞结构.有关说法中正确的是C
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘分子间存在非极性键和范德华力
(7)已知CaF2晶体(图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻且最近的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$a3ρNA
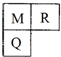 M、R、Q三种短周期元素在元素周期表中的相对位置如图所示,已知M、Q可分别与R形成化合物X和Y,M与R的质子数之和为Q的质子数,下列说法中,正确的是( )
M、R、Q三种短周期元素在元素周期表中的相对位置如图所示,已知M、Q可分别与R形成化合物X和Y,M与R的质子数之和为Q的质子数,下列说法中,正确的是( )①M、Q是农作物所必需的营养元素
②X的种类比Y的多
③稳定性:M的氢化物弱于Q的氢化物
④Q的最高价氧化物对应水化物能与M的氢化物形成三种盐.
| A. | ①②③④ | B. | ①②④ | C. | ②③ | D. | ①② |
| A. | 4.6g 由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA | |
| B. | 0.2 g D216O中含有的质子数,中子数,电子数均为0.1NA | |
| C. | 铁与足量稀硝酸反应时,生产0.1mol NO转移的电子数为0.3NA | |
| D. | 6.2克白磷分子(P4)中含P-P键为0.05NA |
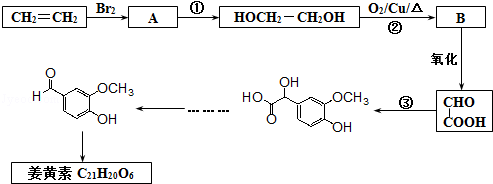
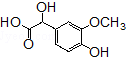 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基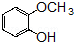
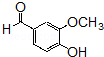 的同分异构体的结构简式
的同分异构体的结构简式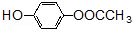

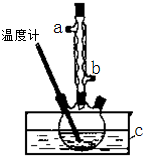 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):