题目内容
下列物质变化的现象.不可以通过分子间作用力解释的是( )
| A、HF,H2O的沸点比HCl,H2S的沸点高很多 | B、正戊烷的沸点比新戊烷的沸点高 | C、 | D、Na2O的熔点比MgO的熔点低 |
分析:A.HF,H2O的沸点比HCl,H2S的沸点高很多,是因为HF,H2O含有氢键;
B.正戊烷的沸点比新戊烷的沸点高,同分异构体中支链越多沸点越低;
C. ,前者易形成分子内氢键,后者易形成分子间氢键;
,前者易形成分子内氢键,后者易形成分子间氢键;
D.离子晶体熔点与离子半径和离子所带电荷有关.
B.正戊烷的沸点比新戊烷的沸点高,同分异构体中支链越多沸点越低;
C.
 ,前者易形成分子内氢键,后者易形成分子间氢键;
,前者易形成分子内氢键,后者易形成分子间氢键;D.离子晶体熔点与离子半径和离子所带电荷有关.
解答:解:A.HF,H2O的沸点比HCl,H2S的沸点高很多,是因为HF,H2O含有氢键,所以能通过分子间作用力解释,故A可以;
B.正戊烷的沸点比新戊烷的沸点高,同分异构体中支链越多沸点越低,所以能通过分子间作用力解释,故B可以;
C. ,前者易形成分子内氢键,后者易形成分子间氢键,所以能通过分子间作用力解释,故C可以;
,前者易形成分子内氢键,后者易形成分子间氢键,所以能通过分子间作用力解释,故C可以;
D.离子晶体熔点与离子半径和离子所带电荷有关,离子半径越小和离子所带电荷越多,熔点越高,所以不能通过分子间作用力解释,故D不可以;
故选D.
B.正戊烷的沸点比新戊烷的沸点高,同分异构体中支链越多沸点越低,所以能通过分子间作用力解释,故B可以;
C.
 ,前者易形成分子内氢键,后者易形成分子间氢键,所以能通过分子间作用力解释,故C可以;
,前者易形成分子内氢键,后者易形成分子间氢键,所以能通过分子间作用力解释,故C可以;D.离子晶体熔点与离子半径和离子所带电荷有关,离子半径越小和离子所带电荷越多,熔点越高,所以不能通过分子间作用力解释,故D不可以;
故选D.
点评:本题考查晶体的类型的判断以及影响性质的因素,题目难度不大,注意晶体的类型不同,熔沸点不同,特别是影响晶体物理性质的因素,要牢固把握.

练习册系列答案
相关题目
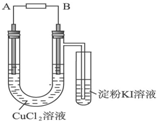 某学生用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,装置如图所示.
某学生用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,装置如图所示. 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( ) 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )