题目内容
 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.氨气是一种重要的化工原料,自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
(1)在微电子工业中,氨水可作H2O2的清除剂,产物不污染环境.该反应的化学方程式为:
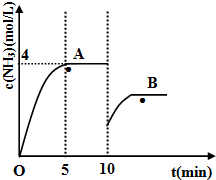
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为amol?L-1和bmol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.在10min时采取的措施是
(3)氨气溶于水得到氨水,在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数K=
Ⅱ工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如表(原料气各成分的体积分数为:SO27%,O211%,N282%):
| 压强/MPa转化率/%温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(5)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
(6)某温度下,向1L密闭容器中开始充入2mol SO2和1mol O2,在V2O5催化剂存在时反应达到平衡,压强减小为开始时的
| 7 |
| 10 |
考点:化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题
分析:(1)双氧水具有强氧化性、氨气具有还原性,二者反应产物不污染环境,则生成氮气和水;
(2)根据图象知,氨气的浓度减小,容器的体积不变,则氨气的物质的量减少;温度不变、化学平衡常数不变;K=
;
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据K=
计算;
(4)压强一定时,根据温度与转化率之间的关系确定反应热;
(5)根据压强增大与二氧化硫转化率及对设备要求分析;
(6)温度不变时,气体的物质的量之比等于其压强之比,据此计算三氧化硫的平衡浓度.
(2)根据图象知,氨气的浓度减小,容器的体积不变,则氨气的物质的量减少;温度不变、化学平衡常数不变;K=
| c2(NH3) |
| c(N2)?c3(H2) |
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据K=
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
(4)压强一定时,根据温度与转化率之间的关系确定反应热;
(5)根据压强增大与二氧化硫转化率及对设备要求分析;
(6)温度不变时,气体的物质的量之比等于其压强之比,据此计算三氧化硫的平衡浓度.
解答:
解:(1)双氧水具有强氧化性、氨气具有还原性,二者反应产物不污染环境,则生成氮气和水,反应方程式为2NH3+3H2O2=N2+6H2O,
故答案为:2NH3+3H2O2=N2+6H2O;
(2)10min时,氨气的浓度减小,容器的体积不变,则改变的条件是移去部分氨气,温度不变、化学平衡常数不变,所以点A的平衡常数K等于B点的平衡常数,化学平衡常数K=
,
故答案为:移去部分氨气;=;
;
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=
mol/L,混合后反应前c(NH3?H2O)=
mol/L,则反应后c(NH3?H2O)=(
-
)mol/L,K=
=
=
,
故答案为:
;
(4)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应,
故答案为:压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;
(5)增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,所以SO2的催化氧化采用常压而不是高压,
故答案为:增大压强对提高SO2转化率无显著影响,反而会增加成本;
(6)温度不变,同一容器中气体的物质的量之比等于其压强之比,
设平衡时反应生成SO3的物质的量为2xmol
2SO2(g)+O2(g)?2SO3(g)
开始量 2mol 1mol 0
反应转化量 2xmol xmol 2xmol
平衡量 (2-2x)mol (1-x)mol 2xmol
=
,
=
解得x=0.9mol,
故平衡时SO3的浓度=2x=2×0.9mol/L=1.8mol/L,
故答案为:1.8mol/L.
故答案为:2NH3+3H2O2=N2+6H2O;
(2)10min时,氨气的浓度减小,容器的体积不变,则改变的条件是移去部分氨气,温度不变、化学平衡常数不变,所以点A的平衡常数K等于B点的平衡常数,化学平衡常数K=
| c2(NH3) |
| c(N2).c3(H2) |
故答案为:移去部分氨气;=;
| c2(NH3) |
| c(N2).c3(H2) |
(3)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=
| b |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
| ||
|
| 10-7b |
| a-b |
故答案为:
| 10-7b |
| a-b |
(4)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应,
故答案为:压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;
(5)增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,所以SO2的催化氧化采用常压而不是高压,
故答案为:增大压强对提高SO2转化率无显著影响,反而会增加成本;
(6)温度不变,同一容器中气体的物质的量之比等于其压强之比,
设平衡时反应生成SO3的物质的量为2xmol
2SO2(g)+O2(g)?2SO3(g)
开始量 2mol 1mol 0
反应转化量 2xmol xmol 2xmol
平衡量 (2-2x)mol (1-x)mol 2xmol
| P平衡 |
| P开始 |
| n平衡 |
| n开始 |
| ||
| P开始 |
| 3-x |
| 3 |
解得x=0.9mol,
故平衡时SO3的浓度=2x=2×0.9mol/L=1.8mol/L,
故答案为:1.8mol/L.
点评:本题考查了化学平衡常数的有关计算,温度不变,化学平衡常数不变,根据平衡常数公式进行解答,难点是(3),题目难度中等.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列各组物质加入足量水,形成悬浊液,一段时间后,加入过量盐酸,浑浊部分消失且有无色无味气体生成的是( )
| A、Ba(NO3)2和Na2SO3 |
| B、BaCO3和Na2SO4 |
| C、BaCl2和Na2SO4 |
| D、Ca(HCO3)2和Ca(OH)2 |
下列说法中正确的是( )
| A、摩尔是七个物理量之一 |
| B、摩尔是物质的质量单位 |
| C、1mol水中含有1mol氧和2mol氢 |
| D、0.5mol NaOH中含有Na+为0.5NA |
从化学试剂商店买来的氢氧化钠试剂瓶上所贴的危险化学品标志是( )
A、 |
B、 |
C、 |
D、 |
下列有关物质性质的比较,正确的是( )
| A、热稳定性:HF<HCl<HBr |
| B、微粒半径:O2->Mg2+>Cl- |
| C、第一电离能:Si>Al>Mg |
| D、电负性:Si>Al>Mg |