题目内容
某化学课外活动小组,为了分析某氧化铜矿的组成(主要成分是CuO,还含有FeO、Fe2O3),并探讨用氧化铜矿粉生产硫酸铜晶体(CuSO4?5H2O)的主要工艺.
查资料知:
①当溶液中某种离子浓度小于10-5mol/L时即可看作完全沉淀;
②各沉淀的Ksp如下:
室温下,在氧化铜矿粉中加入足量稀硫酸,使矿粉充分溶解,得到100mL酸浸液,实验操作如下:

假设实验过程中溶液体积不变,按要求回答下列问题:
(1)操作②中最好选用的氧化剂X是 (填编号).
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
(2)确定操作①既含有Fe2+,又含有Fe3+的操作步骤是 .
(3)若操作②中加入氧化剂X后,Fe2+恰好全部被氧化,此时溶液中c (Fe3+)=0.030mol/L,当溶液的pH= 时,Fe3+才能完全沉淀(已知lg 2=0.30).
(4)请在如图a、b、c处完善所缺步骤及所添加试剂的化学式.可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液.

(5)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3,若首先生成CuCO3沉淀,根据该实验可得出的结论是 (填序号)
A.Ksp( CuCO3)<Ksp (CaCO3) B.c ( Cu2+)<c ( Ca2+)
C.
>
D.
<
.
查资料知:
①当溶液中某种离子浓度小于10-5mol/L时即可看作完全沉淀;
②各沉淀的Ksp如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 1.25×10-36 |

假设实验过程中溶液体积不变,按要求回答下列问题:
(1)操作②中最好选用的氧化剂X是
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
(2)确定操作①既含有Fe2+,又含有Fe3+的操作步骤是
(3)若操作②中加入氧化剂X后,Fe2+恰好全部被氧化,此时溶液中c (Fe3+)=0.030mol/L,当溶液的pH=
(4)请在如图a、b、c处完善所缺步骤及所添加试剂的化学式.可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液.

(5)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3,若首先生成CuCO3沉淀,根据该实验可得出的结论是
A.Ksp( CuCO3)<Ksp (CaCO3) B.c ( Cu2+)<c ( Ca2+)
C.
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(CuCO2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
考点:物质的分离、提纯的基本方法选择与应用,探究物质的组成或测量物质的含量
专题:
分析:(1)将亚铁离子转化为铁离子,在离子转化过程中最好不引入新的杂质;
(2)亚铁离子的检验根据其还原性,而铁离子与硫氰化钾显血红色;
(3)根据Ksp=c(Fe3+)?[c(OH-)]3=1.25×10-36,根据Fe3+离子的浓度为浓度小于10-5mol/L,计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值;
(4)加稀硫酸溶解氢氧化铜,蒸发浓缩,降温结晶,然后过滤,洗涤干燥得到硫酸铜晶体;
(5)先生成CuCO3沉淀,说明溶液中铜离子生成碳酸铜沉淀需要的碳酸根离子浓度
小于钙离子生成碳酸钙沉淀需要的碳酸根离子浓度
,据此进行解答.
(2)亚铁离子的检验根据其还原性,而铁离子与硫氰化钾显血红色;
(3)根据Ksp=c(Fe3+)?[c(OH-)]3=1.25×10-36,根据Fe3+离子的浓度为浓度小于10-5mol/L,计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值;
(4)加稀硫酸溶解氢氧化铜,蒸发浓缩,降温结晶,然后过滤,洗涤干燥得到硫酸铜晶体;
(5)先生成CuCO3沉淀,说明溶液中铜离子生成碳酸铜沉淀需要的碳酸根离子浓度
| Ksp(CuCO3) |
| c(Cu2+) |
| Ksp(CaCO3) |
| c(Ca2+) |
解答:
解:(1)将亚铁离子转化为铁离子,在离子转化过程中最好不引入新的杂质,所以最好的氧化剂为双氧水,故选:d;
(2)亚铁离子的检验根据其还原性,而铁离子与硫氰化钾显血红色,则方法为各取两份溶液①少许,向其中一份中滴入酸性高锰酸钾,如果紫色褪去,说明溶液中有亚铁离子;向另一份溶液中滴加硫氰化钾溶液,如果溶液呈血红色,说明溶液中有铁离子,
故答案为:各取两份溶液①少许,向其中一份中滴入酸性高锰酸钾,如果紫色褪去,说明溶液中有亚铁离子;向另一份溶液中滴加硫氰化钾溶液,如果溶液呈血红色,说明溶液中有铁离子;
(3)c(OH-)=
=5×10-11mol/L,所以c(H+)=
=2×10-4mol/L,所以PH=4-lg2=4-0.30=3.7,故答案为:3.7;
(4)加稀硫酸溶解氢氧化铜,蒸发浓缩,降温结晶,然后过滤,洗涤干燥得到硫酸铜晶体,故答案为:稀硫酸,降温结晶,洗涤;
(5)碳酸铜、碳酸钙的溶度积分别为:Ksp(CuCO3)=c(Cu2+)?c(CO32-)、Ksp(CaCO3)=c(Ca2+)?c(CO32-),向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,说明铜离子生成碳酸铜沉淀需要的碳酸根离子浓度小于钙离子生成碳酸钙沉淀需要的碳酸根离子,即
<
,整理得:
>
,
故答案为:C.
(2)亚铁离子的检验根据其还原性,而铁离子与硫氰化钾显血红色,则方法为各取两份溶液①少许,向其中一份中滴入酸性高锰酸钾,如果紫色褪去,说明溶液中有亚铁离子;向另一份溶液中滴加硫氰化钾溶液,如果溶液呈血红色,说明溶液中有铁离子,
故答案为:各取两份溶液①少许,向其中一份中滴入酸性高锰酸钾,如果紫色褪去,说明溶液中有亚铁离子;向另一份溶液中滴加硫氰化钾溶液,如果溶液呈血红色,说明溶液中有铁离子;
(3)c(OH-)=
| 3 |
| ||
| 1×10-14 |
| 5×10-11 |
(4)加稀硫酸溶解氢氧化铜,蒸发浓缩,降温结晶,然后过滤,洗涤干燥得到硫酸铜晶体,故答案为:稀硫酸,降温结晶,洗涤;
(5)碳酸铜、碳酸钙的溶度积分别为:Ksp(CuCO3)=c(Cu2+)?c(CO32-)、Ksp(CaCO3)=c(Ca2+)?c(CO32-),向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,说明铜离子生成碳酸铜沉淀需要的碳酸根离子浓度小于钙离子生成碳酸钙沉淀需要的碳酸根离子,即
| Ksp(CuCO3) |
| c(Cu2+) |
| Ksp(CaCO3) |
| c(Ca2+) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
故答案为:C.
点评:本题考查了硫酸铜晶体的制备、难溶物溶解平衡及沉淀转化的本质,题目难度较大,合理分析题中制备流程及制取原理是解题根据,(5)为难点、易错点,注意相同类型的难溶物,其溶度积越小,溶解度越小.

练习册系列答案
相关题目
甲、乙、丙三种物质由如下图所示的转化关系,下表中的各组物质不能实现如图转化的是( )

| 甲 | 乙 | 丙 | |
| A | AlCl3 | Al | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | NaCl | NaHCO3 | Na2CO3 |
| D | CO2 | (NH4)2CO3 | NH3 |
| A、A | B、B | C、C | D、D |
在水溶液中能大量共存的一组离子是( )
| A、Na+、Al3+、Cl-、CO32- |
| B、Cu2+、Fe3+、Cl-、SO42- |
| C、NH4+、Cl-、OH-、HCO3- |
| D、H+、Fe2+、Cl-、NO3- |
FeCl3溶液和Fe(OH)3胶体具有的共同性质是( )
| A、都能透过滤纸 |
| B、都呈红褐色 |
| C、分散质具有相同的微粒直径 |
| D、都可以产生丁达尔效应 |
已知某高聚物的结构式是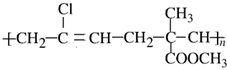 ,其单体的名称为( )
,其单体的名称为( )
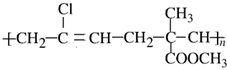 ,其单体的名称为( )
,其单体的名称为( )| A、氯乙烯、乙烯和甲基丙烯酸甲酯 |
| B、2-氯-1,3-丁二烯和丁烯酸甲酯 |
| C、3-氯-1,3-丁二烯和丙烯酸甲酯 |
| D、2-甲基丙烯酸甲酯和2-氯-1,3-丁二烯 |
 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )| A、其分子中含有2个手性碳原子 |
| B、既能发生加聚反应,又能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
下列溶液中微粒的浓度关于不正确的是( )
| A、NaClO溶液中:c(Na+)=c(HClO)+c(ClO-) |
| B、等体积、等物质的量浓度的NaX和弱酸HX混合,所得溶液中:c(Na+)>c(X-)>c(H+)>c(OH-) |
| C、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH4+)>c(Cl-)>c(NH3?H2O)>c(OH-)>c(H+) |
| D、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |

 ABCDE五种物质均含有某种常见的金属元素,X为稀盐酸,Y为KOH 溶液,它们的转化关系如图所示(部分生成物未列出)
ABCDE五种物质均含有某种常见的金属元素,X为稀盐酸,Y为KOH 溶液,它们的转化关系如图所示(部分生成物未列出)