题目内容
甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
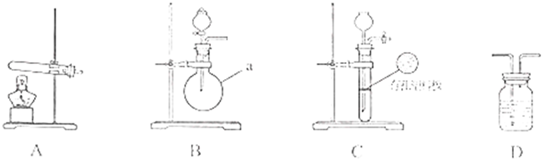
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。

甲小组测得:反应前氧化铜的质量为![]() 、氧化铜反应后剩余固体的质量为
、氧化铜反应后剩余固体的质量为![]()
![]() 生成氮气在标准状况下的体积
生成氮气在标准状况下的体积![]() 。
。
乙小组测得:洗气前装置D的质量![]() 、洗气后装置后D的质量
、洗气后装置后D的质量![]() 、生成氮气在标准状况下的体积
、生成氮气在标准状况下的体积![]() 。
。
请回答下列问题:
(1)写出仪器a的名称: 。
(2)检查A装置气密性的操作时 。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③
|
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是 。 为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果。该药品的名称是 。
【答案】:(1)圆底烧瓶。(2)将导管接入盛水的水槽中,用手握住试管,有气泡产生,放手后能形成一段稳定的水柱,说明气密性良好。
(3)①![]() ②B装置。浓氨水中存在
②B装置。浓氨水中存在![]() ,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时,氢氧化钠固体溶于水后发生电离,生成大量
,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时,氢氧化钠固体溶于水后发生电离,生成大量![]() ,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)
,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)![]() (5)洗气前装置D前后的质量差包含未参加反应的NH3,使得氢原子的物质的量增大,比值减小,碱石灰。
(5)洗气前装置D前后的质量差包含未参加反应的NH3,使得氢原子的物质的量增大,比值减小,碱石灰。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(17分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:
实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
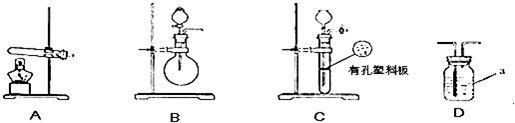
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称 。
(2)检查A装置气密性的操作是 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、硫酸、硫酸铵 | 反应的化学方程式为 ① 。 |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 。 |
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是 。
甲.乙两个研究性学习小组为测定氨分子中氮.氢原子个数比,设计了如下实验流程:

下图A.B.C为甲.乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

实验开始前装置中的空气已排尽。甲小组测得:反应前氧化铜的质量为 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积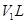 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
(1)写出仪器a的名称: 。
(2)甲.乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
|
|
实验装置 |
实验药品 |
制备原理 |
|
甲小组 |
A |
氢氧化钙.硫酸铵 |
反应的化学方程式为 ① |
|
乙小组 |
② |
浓氨水.氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③
|
(3)甲小组用所测数据计算出氨分子中氮.氢的原子个数之比为 。
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮.氢的原子个数比明显小于理论值,其原因可能是 。
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果。该药品的名称是 。
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.