题目内容
19.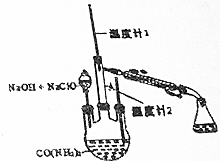 水合肼(N2H4•H2O)常用作还原剂和抗氧剂,其熔点为-40℃,沸点118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H20)涉及下列反应:
水合肼(N2H4•H2O)常用作还原剂和抗氧剂,其熔点为-40℃,沸点118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H20)涉及下列反应:C0(NH2)2+2Na0H+NaCl0=Na2C03+N2H4•H20+NaC1
N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl.请回答下列问题
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有BD(填标号).
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)将C12通入30%Na0H溶液制备NaC1O的化学方程式C12+2Na0H=NaC1O+NaC1+H2O.
(3)实验时,如果将NaOH和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果使生成的N2H4•H2O被氧化,造成N2H4•H2O产率下降.
(4)实验时可根据温度计1中测得的温度判断N2H4•H2O开始蒸出.
分析 (1)配制一定质量分数的溶液所需玻璃仪器为量筒、烧杯、玻璃棒;
(2)C12通入30%Na0H溶液生成NaC1O、NaC1和水;
(3)根据反应N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl进行判断;
(4)实验时可根据N2H4•H2O沸点判断将N2H4•H2O开始蒸出;
解答 解:(1)配制一定质量分数的溶液所需玻璃仪器为量筒、烧杯、玻璃棒,故选BD;
(2)C12通入30%Na0H溶液生成NaC1O、NaC1和水,反应的方程式为C12+2Na0H=NaC1O+NaC1+H2O,
故答案为:C12+2Na0H=NaC1O+NaC1+H2O;
(3)根据反应N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl可知,如果将NaOH和NaClO的混合溶液一次性加入三颈烧瓶,可能会使生成的N2H4•H2O被氧化,造成N2H4•H2O产率下降,
故答案为:使生成的N2H4•H2O被氧化,造成N2H4•H2O产率下降;
(4)实验时可根据N2H4•H2O沸点判断将N2H4•H2O开始蒸出,即根据温度计1中测得的温度判断,
故答案为:温度计1中测得的温度;
点评 本题考查物质制备实验,涉及氧化还原反应、对装置与操作的分析评价、物质分离提纯等,关键是对题目信息的理解应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.为了探究外界条件对该反应化学反应速率的影响,某研究小组进行了以下实验:以HCl和碳酸钙的反应为研究对象,实验方案与数据记录如下表,(t表示收集a mL CO2所需的时间.
(1)设计实验1和实验2的目的是研究固体表面积对化学反应速率的影响.
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4(填序号)作对比.
(3)将实验2和实验3作对比,t2>t3(填“>”、“<”或“=”).
| 序号 | 反应 温度/℃ | c(HCl)/ mol•L-1 | v(HCl) /mL | 碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4(填序号)作对比.
(3)将实验2和实验3作对比,t2>t3(填“>”、“<”或“=”).
7.下列图示实验装置正确的是( )
| A. |  制乙烯 | B. |  测量SO2的体积 | C. |  铁丝燃烧 | D. |  喷泉实验 |
4.在无色透明溶液中,不能大量共存的离子组是( )
| A. | Cu2+、Na+、SO42-、Ba2+ | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Ba2+、Na+、OH-、NO3- |
9.下列说法,正确的是( )
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | s轨道与s轨道之间可以在任何方向上成键,所以共价键都没有方向性 | |
| D. | s轨道与p轨道只有沿着一定的方向,才能发生最大程度的重叠,形成共价键 |


 如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.
如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.