��Ŀ����
 �ɶ����ڳ���Ԫ���γɵĴ�����A��B��C��D��E��F��Xת����ϵ��ͼ��ʾ��ijЩ��������ȥ����
�ɶ����ڳ���Ԫ���γɵĴ�����A��B��C��D��E��F��Xת����ϵ��ͼ��ʾ��ijЩ��������ȥ������֪��B��XΪ���ʣ�������DΪ��ɫҺ�壬A��B��ͬһ��Ԫ�أ�
��ش��������⣺
��1����E�����Ǵ�����Ⱦ�F��һԪǿ�ᣮ
��д��E��F��Ӧ�Ļ�ѧ����ʽ��
������25��ʱ0.1mol?L-1 A��ˮ��Һ���������м�������0.1mol?L-1��ϡ���ᣬ��������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳����
���ڳ����£���V1 L pH=a��A��ˮ��Һ�м���V2 L pH=b�����ᣬ��a+b=14����ǡ����ȫ��Ӧ����V1��V2�Ĺ�ϵΪVl
��2����E���岻�Ǵ�����Ⱦ�F�Ƕ�Ԫ���ᣮ
��B����Ԫ�������ڱ��е�λ��
��д����������C��Ӧ�Ļ�ѧ����ʽ��
���㣺������ƶ�
ר�⣺�ƶ���
��������1��B��XΪ���ʣ�B����X������Ӧ�õ�E��E�����Ǵ�����Ⱦ���ˮ��Ӧ�õ�F��һԪǿ�ᣬ��FΪ���ᣬ����֪��BΪ������XΪ������CΪNO��DΪ����������A��������Ӧ�õ�D��NO��������DΪ��ɫҺ�壬��A��B��ͬһ��Ԫ�أ���AΪ������DΪˮ��
��2��B��XΪ���ʣ�B����X������Ӧ�õ�E����E���岻�Ǵ�����Ⱦ���ˮ��Ӧ�õ�F�Ƕ�Ԫ���ᣬ��FΪ̼�ᣬBΪ̼��XΪ������CΪCO��EΪ������̼��AΪ����
��2��B��XΪ���ʣ�B����X������Ӧ�õ�E����E���岻�Ǵ�����Ⱦ���ˮ��Ӧ�õ�F�Ƕ�Ԫ���ᣬ��FΪ̼�ᣬBΪ̼��XΪ������CΪCO��EΪ������̼��AΪ����
���
�⣺��1��B��XΪ���ʣ�B����X������Ӧ�õ�E��E�����Ǵ�����Ⱦ���ˮ��Ӧ�õ�F��һԪǿ�ᣬ��FΪ���ᣬ����֪��BΪ������XΪ������CΪNO��DΪ����������A��������Ӧ�õ�D��NO��������DΪ��ɫҺ�壬��A��B��ͬһ��Ԫ�أ���AΪ������DΪˮ��
��E��F�Ƕ���������ˮ��Ӧ����������NO����Ӧ�Ļ�ѧ����ʽΪ��3NO2+H2O=2HNO3+NO��
�ʴ�Ϊ��3NO2+H2O=2HNO3+NO��
������25��ʱ0.1mol?L-1 NH3��ˮ��Һ���������м�������0.1mol?L-1��ϡ���ᣬ����ǡ�÷�Ӧ�õ�NH4HSO4��NH4HSO4��ȫ���룬��Һ�����ԣ���c��H+����c��OH-�� ����Һ��笠�����ˮ�⣬��c��H+����c�� SO42-��������Һ������Ũ�ȴ�С˳��Ϊ��c��H+����c�� SO42-����c��NH4+����c��OH-����
�ʴ�Ϊ��c��H+����c�� SO42-����c��NH4+����c��OH-����
���ڳ����£���V1L pH=a�İ�ˮ��Һ��c��OH-��=10 a-14 mol/L��V2L pH=b��������Һ��c��H+��=10-b mol/L����a+b=14������c��OH-��=c��H+��=10-b mol/L=10 a-14 mol/L��c��NH3��H2O��������ǡ�÷�Ӧ��HCl�����ʵ������ڰ��������ʵ���������v1��v2�Ĺ�ϵΪV1��V2��
��pH��NH4Cl��Һ�����ᣬ��pH=n���Ȼ����Һ����ˮ�������c��H+��=10-n mol/L����������ˮ�������c��H+��=10n-14 mol/L��ǰ��Ϊ���ߵ�108������10-n mol/L��10n-14 mol/L=108�����n=3��
�ʴ�Ϊ������3��
��2��B��XΪ���ʣ�B����X������Ӧ�õ�E����E���岻�Ǵ�����Ⱦ���ˮ��Ӧ�õ�F�Ƕ�Ԫ���ᣬ��FΪ̼�ᣬBΪ̼��XΪ������CΪCO��EΪ������̼��AΪ����
��BΪ̼Ԫ�أ�Ԫ�������ڱ��е�λ���ǣ��ڶ����ڢ�A�壬�ʴ�Ϊ���ڶ����ڢ�A�壻
����������CO��Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+3CO
2 Fe+3CO2��
���������������̼ͨ������������Һ�еò�����CaCO3����Ksp=2.8��10-9���ֽ��ó�������0.1mol?L-1��CaCl2��Һ�У������ܶȻ�ֻ���¶�Ӱ�죬��Ksp���䣬
��CO32-��Ũ��Ϊxmol/L������Һ�и�����Ũ��Ϊ��0.1+x��mol/L����x��x+0.1��=2.8��10-9����x+0.1��0.1����x��2.8��10-8��
�ʴ�Ϊ��Fe2O3+3CO
2 Fe+3CO2�����䣻2.8��10-8mol/L��
��E��F�Ƕ���������ˮ��Ӧ����������NO����Ӧ�Ļ�ѧ����ʽΪ��3NO2+H2O=2HNO3+NO��
�ʴ�Ϊ��3NO2+H2O=2HNO3+NO��
������25��ʱ0.1mol?L-1 NH3��ˮ��Һ���������м�������0.1mol?L-1��ϡ���ᣬ����ǡ�÷�Ӧ�õ�NH4HSO4��NH4HSO4��ȫ���룬��Һ�����ԣ���c��H+����c��OH-�� ����Һ��笠�����ˮ�⣬��c��H+����c�� SO42-��������Һ������Ũ�ȴ�С˳��Ϊ��c��H+����c�� SO42-����c��NH4+����c��OH-����
�ʴ�Ϊ��c��H+����c�� SO42-����c��NH4+����c��OH-����
���ڳ����£���V1L pH=a�İ�ˮ��Һ��c��OH-��=10 a-14 mol/L��V2L pH=b��������Һ��c��H+��=10-b mol/L����a+b=14������c��OH-��=c��H+��=10-b mol/L=10 a-14 mol/L��c��NH3��H2O��������ǡ�÷�Ӧ��HCl�����ʵ������ڰ��������ʵ���������v1��v2�Ĺ�ϵΪV1��V2��
��pH��NH4Cl��Һ�����ᣬ��pH=n���Ȼ����Һ����ˮ�������c��H+��=10-n mol/L����������ˮ�������c��H+��=10n-14 mol/L��ǰ��Ϊ���ߵ�108������10-n mol/L��10n-14 mol/L=108�����n=3��
�ʴ�Ϊ������3��
��2��B��XΪ���ʣ�B����X������Ӧ�õ�E����E���岻�Ǵ�����Ⱦ���ˮ��Ӧ�õ�F�Ƕ�Ԫ���ᣬ��FΪ̼�ᣬBΪ̼��XΪ������CΪCO��EΪ������̼��AΪ����
��BΪ̼Ԫ�أ�Ԫ�������ڱ��е�λ���ǣ��ڶ����ڢ�A�壬�ʴ�Ϊ���ڶ����ڢ�A�壻
����������CO��Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+3CO
| ||
���������������̼ͨ������������Һ�еò�����CaCO3����Ksp=2.8��10-9���ֽ��ó�������0.1mol?L-1��CaCl2��Һ�У������ܶȻ�ֻ���¶�Ӱ�죬��Ksp���䣬
��CO32-��Ũ��Ϊxmol/L������Һ�и�����Ũ��Ϊ��0.1+x��mol/L����x��x+0.1��=2.8��10-9����x+0.1��0.1����x��2.8��10-8��
�ʴ�Ϊ��Fe2O3+3CO
| ||
����������Ƚ��ۺϣ��漰�����ƶϡ���ҺpH���йؼ��㡢����ˮ�⡢�ܶȻ�����ȣ�����ȷ�ƶ������ǽⱾ��ؼ�����2��Ũ�ȼ���Ϊ�״��㣬ע����Ƽ��㣬�ѶȽϴ�

��ϰ��ϵ�д�
�����Ŀ
���и������ʻ������У�����û���������ϵ���ǣ�������
| A������β��-�⻯ѧ��Ⱦ-���Ժ����������� |
| B������ϴ�·�-ˮ�帻Ӫ����-ˮ�ܶ���������� |
| C��������-�����ն�-Ƥ����֢������ |
| D���˿�����-������CO2Ũ������-���� |
�ò��缫�������ij�������Ȼ��MCl2����Һ�����ռ���1.12L���������������������3.2g����ý�����Ħ�������ǣ�������
| A��64 | B��32 |
| C��64g/mol | D��32g/mol |



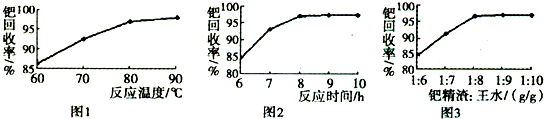
 ��־���������
��־���������