题目内容
3. 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═
某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═H2↑+CuSO4(未注明反应条件),试回答:
(1)该装置的名称是电解池(填“电解池”或“原电池”);
(2)A、B中至少有一种是金属铜(填名称),接电源的正极(填“正极”或“负极”);
(3)写出该装置中发生还原反应的电极反应方程式为2H++2e-=H2↑;
(4)若C溶液为100ml饱和食盐水,A 和B电极均为碳棒,该学生利用图示装置进行电解,写出该电解过程中的总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,当放出标况下112ml氢气时,该溶液的pH=13(室温下).
分析 (1)Cu+H2SO4=H2↑+CuSO4不能自发进行,要是该反应发生,则该装置必须是电解池;
(2)该电解池中,Cu作阳极、金属或石墨作阴极,阳极连接电源正极;
(3)该装置中,阴极上得电子发生还原反应;
(4)用石墨作电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近有氢氧根离子生成,根据氢气和氢氧根离子之间的关系计算氢氧根离子浓度,从而计算溶液的pH;
解答 解:(1)Cu+H2SO4=H2↑+CuSO4不能自发进行,要是该反应发生,则该装置必须是电解池,且Cu作阳极,故答案为:电解池;
(2)该电解池中,Cu作阳极、金属或石墨作阴极,阳极连接电源正极,故答案为:铜;正极;
(3)该装置中,阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(4)用石墨作电极电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成,电池反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;
设生成氢氧根离子的物质的量为x,
2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;
22.4L 2mol
0.112L x
22.4L:2mol=0.112L:x,
x=$\frac{0.112L×2mol}{22.4L}$=0.01mol,
c(OH-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,则溶液的pH=13,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH_+H2↑+Cl2↑,13.
点评 本题考查原电池和电解池原理,根据方程式的自发性判断电池类型,知道原电池和电解池的区别,会书写电极反应式,难点是pH的计算,题目难度不大.

| A. | 青铜 | B. | 硬铝 | C. | 不锈钢 | D. | 金刚石 |
| A. | KCl、NaNO3 | B. | 水、酒精 | C. | Na2CO3、CaCO3 | D. | MgSO4、ZnSO4 |
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量.
(1)若用下列仪器和导管组装实验装置:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞.
②检查装置的气密性.
③在仪器6和5中注入适量水.
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计).
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞.
正确的操作顺序(用操作编号填写)是②①③⑤④.
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含H2S杂质.
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数80%.
| A. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 在c(H+)/C(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
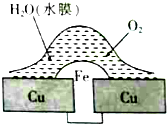
| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
 (1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$;
(1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$;