题目内容
6.某短周期主族元素最高价氧化物对应的水化物化学式为HxRO4(x为正整数).(1)若x=3,R元素为P(填元素符号).将NaxRO4固体在火焰中灼烧,可观祭到火焰的颜色是黄色.
(2)若HxRO4分子中氢和氧的电子总数比R的质子数多16,R为Cl(填元素符号)
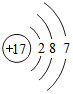
(3)若R与硫的化合物用SRm代表示,SRm分子中电子总数为50,最外层电子数总和为20,则R原子的结构示意图为
 .
.
分析 (1)x=3时,HxRO4为H3RO4,R的最高价为+5价,则R为P元素;NaxRO4为Na3RO4,结合钠元素的焰色反应分析;
(2)根据“HxRO4分子中氢和氧的电子总数比R的质子数多16”列式计算;
(3)设R的核电荷数为y,最外层电子数为z,则:my+16=50、6+zm=20,整理可得:my=34、zm=14,则:$\frac{y}{m}$=$\frac{17}{7}$,结合R为短周期元素分析.
解答 解:(1)若x=3,HxRO4为H3RO4,R的最高价为+5价,R为短周期元素,则R为P元素;NaxRO4为Na3RO4,将Na3RO4固体在火焰中灼烧,可观祭到火焰的呈黄色,
故答案为:P;黄;
(2)若HxRO4分子中氢和氧的电子总数比R的质子数多16,设R的质子数为y,H原子中含有1个电子,则x+8×4-y=16,整理可得:y=16+x,当x=1时y=17,为Cl元素;当x=2时y=18(舍弃);当x=3时y=19(舍弃),通过讨论可知R为Cl元素,
故答案为:Cl;
(3)若R与硫的化合物用SRm代表示,SRm分子中电子总数为50,最外层电子数总和为20,设R的核电荷数为y,最外层电子数为z,则my+16=50、6+zm=20,整理可得:my=34、zm=14,故$\frac{y}{m}$=$\frac{17}{7}$,由于R为短周期元素,则y只能为17,则R为Cl元素,其原子序数为17,最外层含有7个电子,R原子的结构示意图为: ,
,
故答案为: .
.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,明确元素周期律内容、原子构成为解答关键,注意掌握讨论法在推断元素中的应用,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
16.某原子电子排布式为1s22s22p3,下列说法正确的是( )
| A. | 该元素位于第二周期 IIIA族 | |
| B. | 核外有3种能量不同的电子 | |
| C. | 最外层电子占据3个轨道 | |
| D. | 最外层上有3种运动状态不同的电子 |
13.下列现象不适宜用勒夏特列原理解释的是( )
| A. | 工业上用Na2CO3溶液浸泡水垢 | B. | 夏天的食物更易腐败变质 | ||
| C. | 将氨水保存在温度较低处 | D. | 热的纯碱溶液去除油污效果更好 |
1.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. |  量取10.00mLNaOH溶液 | |
| B. |  蒸干氯化铜溶液制CuCl2•2H2O | |
| C. |  关闭活塞a,从b处加水,以检查装置的气密性 | |
| D. | 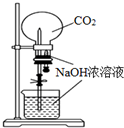 用CO2做喷泉实验 |
11.下列表示正确的是( )
| A. | 氯化钠的分子式:NaCl | B. | 乙醇的结构式:C2H5OH | ||
| C. | 水分子的比例模型: | D. | Mg2+结构示意图: |
18.下列化学式表示的一定是纯净物的是( )
| A. | C3H6 | B. | C3H6O | C. | C3H8 | D. | C3H7OH |
15.常温下,下列物质的溶液中粒子浓度关系不正确的是( )
| A. | pH=1的KHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | CH3COONa和BaCl2混合溶液:c(Na+)+c(Ba2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| C. | 三种相同浓度的铵盐溶液中c(NH4+)从大到小的顺序:NH4HSO4、NH4Cl、NH4HCO3 | |
| D. | 已知AgCl、AgBr、AgI溶度积常数依次为1.6×l0-10、7.7×10-13、8.7×10-17,则对应饱和溶液中c(X-)从大到小的顺序为:Cl-、Br-、I- |
14.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 该有机物中必定含有碳碳双键 |
| B | 向亚硫酸钠溶液中滴加硝酸钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液已变质 |
| C | 向酸性高锰酸钾溶液中滴加双氧水 | 紫色褪去,产生气泡 | H2O2具有还原性 |
| D | 向油脂皂化反应后的溶液中滴入酚酞 | 溶液不变红 | 油脂已经完全皂化 |
| A. | A | B. | B | C. | C | D. | D |