题目内容
下列有关叙述正确的是 ( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
C
解析试题分析:A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+),错误;B、若酸是弱酸,则酸过量,有c(OH-)<c(H+),错误;C、 分子分母同乘c(H+),变为k(CH3COOH)/kw,加水稀释过程中k值不变,正确;D、质子守恒应为c(OH-)=c(H+)+c(HS-)+2c(H2S),错误。
分子分母同乘c(H+),变为k(CH3COOH)/kw,加水稀释过程中k值不变,正确;D、质子守恒应为c(OH-)=c(H+)+c(HS-)+2c(H2S),错误。
考点:考查溶液中离子浓度的关系有关问题。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关“电离平衡”的叙述正确的是( )
| A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 |
| B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡 |
| C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 |
| D.电解质达到电离平衡后,各种离子的浓度相等 |
已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O 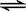 CH3COO—+H3O+ K1=1.75×10-5
CH3COO—+H3O+ K1=1.75×10-5
CH3COO—+H2O 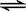 CH3COOH+OH— K2=5.71×10-10
CH3COOH+OH— K2=5.71×10-10
现有50 mL 0.2 mol·L-1醋酸与50 mL 0.2 mol·L-1醋酸钠混合制得溶液甲,下列叙述正确的是
| A.甲溶液的pH >7 |
| B.对甲进行微热,K1、K2同时增大 |
| C.若在甲中加入很少量的NaOH溶液,溶液的pH几乎不变 |
| D.若在甲中加入5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的K1会变大 |
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32—)>c(H2CO3) |
| B.c(Na+)>c(HCO3—)>c(OH―)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,其简单离子都能促进水的电离的是
| A.W2-、X+ | B.X+、Y3+ | C.X+、Z2- | D.Y3+、Z2- |
某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是
A. ×100% ×100% | B.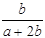 ×100% ×100% |
C.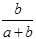 ×100% ×100% | D. ×100% ×100% |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH¯)>c(N3¯)>c(H+) |
| D.0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
对水的电离平衡不产生影响的粒子是
| A.HCl | B.CH3COO- | C.Cl- | D.Fe3+ |
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1L0.2mol·L-1HF溶液中加入1L0.2mol·L-1CaCl2溶液,则下列说法中,正确的是
| A.25℃时,0.lmol·L-1溶液中pH=l |
| B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 |
| D.该体系中HF与CaC12反应产生沉淀 |