题目内容
某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是
A. ×100% ×100% | B.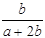 ×100% ×100% |
C.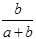 ×100% ×100% | D. ×100% ×100% |
A
解析试题分析:电离度是指弱电解质已电离的物质的物质的量与弱电解质原来的物质的量之比。
HA  H+ + A-
H+ + A-
起始n: (a+b/2)mol 0 0
变化n: b/2mol b/2mol b/2mol
平衡n: amol b/2mol b/2mol
因此,HA的电离度(即转化率)是: ×100%
×100%
考点:弱电解质的有关知识。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
相同温度下,物质的量浓度相同的四种溶液:①CH3COONa ;②NaHSO3;③NaCl;④Na2SiO3,按pH由大到小的顺序排列正确的是
| A.④①③② | B.①④③② | C.①②③④ | D.④③①② |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH?) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH?) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
有①Na2CO3溶液;②CH3C00Na溶液;③NaOH溶液各25mL,物质的量浓度均为0.1 mol/L,
下列说法正确的是( )
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1 mol/L盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
下列有关叙述正确的是 ( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
标准状况下,将2.24LNH3通入1L 0.1mol/L的甲酸溶液中,欲确定所得溶液中NH4+、HCOO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是
①NH3·H2O和HCOOH的电离常数②NH3·H2O和HCOONH4的电离常数③溶液的pH
| A.不需任何数据 | B.必需知道①、②、③三组数据 |
| C.只需知道①、③中的任一组数据 | D.只需知道①、②、③中的任一组数据 |
等物质的量浓度的下列溶液中,c( )最大的是( )
)最大的是( )
| A.NH4HCO3 | B.NH4NO3 | C.(NH4)2CO3 | D.NH4HSO4 |
 )
)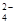 )>c(NH
)>c(NH