题目内容
已知达喜是常用的中和胃酸的药物,其化学成分是铝和镁的碱式盐.
(1)取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比.
(2)在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式.
(1)取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比.
(2)在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式.
考点:化学方程式的有关计算
专题:计算题
分析:(1)产生二氧化碳,发生反应:HCO3-+H+=CO2↑+H2O,根据该阶段消耗的盐酸计算n(HCO3-),根据C元素守恒n(CO32-)=n(HCO3-),
从开始到加入42.5mL盐酸,发生反应:OH-+H+=H2O,CO32-+H+=HCO3-,根据该该阶段消耗的盐酸计算n(OH-);
(2)由已知得1.74 g沉淀为Mg(OH)2,根据Mg元素守恒得碱式盐中含n(Mg2+)=n[Mg(OH)2],(1)中加入盐酸完全反应时,溶液中溶质为MgCl2、AlCl3,利用Cl元素守恒得:n(HCl)=2n(MgCl2)+3n(AlCl3),根据Al元素守恒n(Al3+)=n(AlCl3),再根据质量守恒定律与H元素质量分数判断是否含有结晶水,计算各微粒的物质的量之比,进而确定该碱式盐的化学式.
从开始到加入42.5mL盐酸,发生反应:OH-+H+=H2O,CO32-+H+=HCO3-,根据该该阶段消耗的盐酸计算n(OH-);
(2)由已知得1.74 g沉淀为Mg(OH)2,根据Mg元素守恒得碱式盐中含n(Mg2+)=n[Mg(OH)2],(1)中加入盐酸完全反应时,溶液中溶质为MgCl2、AlCl3,利用Cl元素守恒得:n(HCl)=2n(MgCl2)+3n(AlCl3),根据Al元素守恒n(Al3+)=n(AlCl3),再根据质量守恒定律与H元素质量分数判断是否含有结晶水,计算各微粒的物质的量之比,进而确定该碱式盐的化学式.
解答:
解:(1)产生二氧化碳,发生反应:HCO3-+H+=CO2↑+H2O,当加到HCl的物质的量为2.0 mol/L×42.5 mL×10-3L?mL-1=0.085 mol时开始产生CO2;而当加到2.0 mol/L×45.0 mL×10-3 L?mL-1=0.090 mol时正好反应完全.所以n(CO32-)=n(HCO3-)=0.090 mol-0.085 mol=0.005 mol.
又由于达喜为铝和镁的碱式盐,从开始到加入42.5mL盐酸,发生反应:OH-+H+=H2O,CO32-+H+=HCO3-,所以n(OH-)=0.085 mol-0.005 mol=0.08 mol.
所以
=
=
,
答:该碱式盐样品中氢氧根与碳酸根的物质的量之比为16:1.
(2)由已知得1.74 g沉淀为Mg(OH)2,根据Mg元素守恒得碱式盐中含n(Mg2+)=n[Mg(OH)2]=
=0.03mol,
(1)中加入盐酸完全反应时,溶液中溶质为MgCl2、AlCl3,利用Cl元素守恒得:n(HCl)=2n(MgCl2)+3n(AlCl3),根据Al元素守恒n(Al3+)=n(AlCl3),所以n(Al3+)=
=0.01 mol,
又由(1)得n(OH-)=0.08 mol、n(CO32-)=0.005 mol.因为0.03 mol×24 g/mol+0.01 mol×27 g/mol+0.08 mol×17 g/mol+0.005 mol×60 g/mol=2.65g<3.01 g.所以含有n(H2O)=
=0.02 mol,故n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.01 mol:0.03 mol:0.08 mol:0.005mol:0.02 mol=2:6:16:1:4,所以该碱式盐的化学式为Al2Mg6(OH)16CO3?4H2O.
答:该碱式盐的化学式为Al2Mg6(OH)16CO3?4H2O.
又由于达喜为铝和镁的碱式盐,从开始到加入42.5mL盐酸,发生反应:OH-+H+=H2O,CO32-+H+=HCO3-,所以n(OH-)=0.085 mol-0.005 mol=0.08 mol.
所以
| n(OH-) | ||
n(
|
| 0.08mol |
| 0.005mol |
| 16 |
| 1 |
答:该碱式盐样品中氢氧根与碳酸根的物质的量之比为16:1.
(2)由已知得1.74 g沉淀为Mg(OH)2,根据Mg元素守恒得碱式盐中含n(Mg2+)=n[Mg(OH)2]=
| 1.74g |
| 58g/mol |
(1)中加入盐酸完全反应时,溶液中溶质为MgCl2、AlCl3,利用Cl元素守恒得:n(HCl)=2n(MgCl2)+3n(AlCl3),根据Al元素守恒n(Al3+)=n(AlCl3),所以n(Al3+)=
| 2.0mol/L×45mL×10-3L?mL-1-0.03mol×2 |
| 3 |
又由(1)得n(OH-)=0.08 mol、n(CO32-)=0.005 mol.因为0.03 mol×24 g/mol+0.01 mol×27 g/mol+0.08 mol×17 g/mol+0.005 mol×60 g/mol=2.65g<3.01 g.所以含有n(H2O)=
| 3.01g-2.65g |
| 18g/mol |
答:该碱式盐的化学式为Al2Mg6(OH)16CO3?4H2O.
点评:本题考查化学方程式计算、物质组成确定,明确各阶段发生的反应是解题关键,侧重考查学生对于实验数据的分析处理能力,题目过程复杂,计算量较大,(2)中注意利用质量守恒确定含有结晶水,为易错点,难度较大.

练习册系列答案
相关题目
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、在常温常压下,11.2LN2含有的分子数为NA |
| B、32gO2在标准状况下所占体积约为22.4L |
| C、标准状况下,18gH2O所占的体积约是22.4L |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
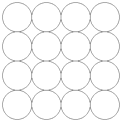 某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)