题目内容
19.将标准状况下的VL HCl(气)溶于水配成1L溶液,得到的盐酸密度为ρg/cm3,则该盐酸的物质的量浓度为( )| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |
分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下VLHCl气体的物质的量,已知配制的溶液体积为1L,然后根据c=$\frac{n}{V}$计算该盐酸的物质的量浓度即可.
解答 解:标准状况VLHCl的物质的量为:n(HCl)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
配制的溶液体积为1L,
则该盐酸的物质的量浓度为:c(HCl)=$\frac{\frac{V}{22.4}mol}{1L}$=$\frac{V}{22.4}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,注意题中配制的是1L溶液,不是加入1L水,为易错点.

练习册系列答案
相关题目
5.将一定量的乙烷完全燃烧,使所有的气体按顺序通过装有无水氯化钙和氢氧化钾的硬质玻璃管,氢氧化钾管的质量增加了4.4g,则乙烷在标准状况下体积( )
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
6.某原电池总反应离子方程式为.2Fe3++Fe?3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3 和HCl混合溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为Fe(NO3)3 和HNO3混合溶液 | |
| C. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和H2SO4混合溶液 | |
| D. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和HCl混合溶液 |
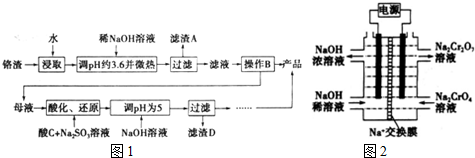
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
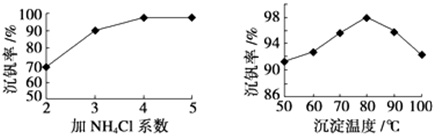
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.

(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
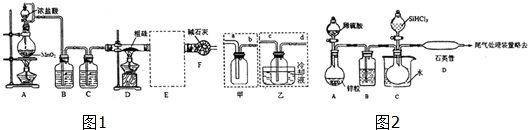
14.硫代硫酸钠晶体(Na2S2O3•5H2O,式量248)俗称海波或大苏打,它易溶于水,且溶解度随温度升高而显著增大,难溶于乙醇,加热时易分解,可用于照相行业的定影剂.实验室模拟工业制备硫代硫酸钠晶体通常有以下方法,请回答有关问题.
亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3•5H2O,简易实验流程如下:

(1)硫粉用乙醇润湿的目的是有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率.
(2)操作中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠晶体脱水并分解.
(3)所得粗产品一般通过重结晶方法提纯.
硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:

(4)装置C的作用是吸收反应生成的CO2和多余的SO2,防止污染大气.
(5)为充分利用SO2,对装置B进行改进(如上右图所示):当A中反应发生后,关闭旋塞b、e,打开a、c、d,往B中溶液通入SO2,未反应的SO2被收集到气囊f中.待f收集到较多气体时(假定此时装置A中反应已停止),关闭旋塞ac,打开旋塞bde,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中.再将g中的气体挤压入f中,如此反复,直至完全反应.
(6)为测定硫代硫酸钠晶体粗产品的纯度.某兴趣小组称取5.0克粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
①该产品的纯度是93.0%.
②可能造成实验结果偏低的有BD(填编号).
A.锥形瓶用蒸馏水润洗
B.滴定管未用Na2S2O3溶液润洗
C.滴定终点时俯视读数
D.若滴定前滴定管尖嘴处有气泡,滴定后消失.
亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3•5H2O,简易实验流程如下:

(1)硫粉用乙醇润湿的目的是有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率.
(2)操作中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠晶体脱水并分解.
(3)所得粗产品一般通过重结晶方法提纯.
硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:

(4)装置C的作用是吸收反应生成的CO2和多余的SO2,防止污染大气.
(5)为充分利用SO2,对装置B进行改进(如上右图所示):当A中反应发生后,关闭旋塞b、e,打开a、c、d,往B中溶液通入SO2,未反应的SO2被收集到气囊f中.待f收集到较多气体时(假定此时装置A中反应已停止),关闭旋塞ac,打开旋塞bde,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中.再将g中的气体挤压入f中,如此反复,直至完全反应.
(6)为测定硫代硫酸钠晶体粗产品的纯度.某兴趣小组称取5.0克粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
| 滴定次数 | 1 | 2 | 3 |
| 消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
②可能造成实验结果偏低的有BD(填编号).
A.锥形瓶用蒸馏水润洗
B.滴定管未用Na2S2O3溶液润洗
C.滴定终点时俯视读数
D.若滴定前滴定管尖嘴处有气泡,滴定后消失.
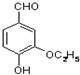 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.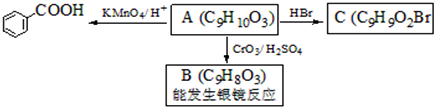
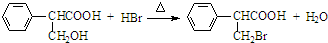 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.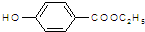 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用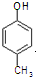 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).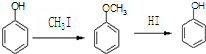

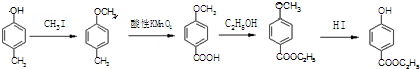
 .
.