题目内容
4.为减少铬渣的危害并从中提取硫酸钠,设计工艺如图1: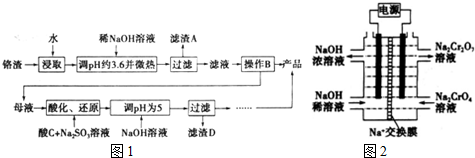
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol•L-1)时pH分别为3.6和5.
(1)“微热“除能加快反应速率外,还可以促进Fe3+水解生成Fe(OH)3而除去.
(2)酸化后Cr2O72-可被SO32-还原成Cr3+离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;酸C为H2SO4,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32mol4•L-4.
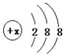
(3)根据2CrO4-+2H+═Cr2O72-+H2O设计图示装置如图2(均为惰性电极) 电解Na2CrO4的溶液制取Na2Cr2O72-,图中右侧电极连接电源的正极.当电路中通过0.2mol电子时,该装置中产生的气体在标准状况下的体积为3.36L.若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O.
分析 (1)因为水解反应吸热,故“微热”可以促进Fe3+水解生成Fe(OH)3而除去;
(2)酸化后Cr2O72-可被SO32-还原成Cr3+,SO32-变为SO42-,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;酸C为H2SO4是为保证最后得到纯净的硫酸钠;根据Cr3+完全沉淀(c≤1.0×10-5 mol•L-1)时pH为5,得c(H+)═10-5 mol/L,c(OH-)=10-9 mol•L-1,然后将数据代入溶度积常数Ksp[Cr(OH)3]=(Cr3+)•c3(OH-)计算;
(3)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成4H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极;电极反应式:2H2O-4e-=O2↑+4H+,阴极电极反应式:2H++2e-=H2↑,根据电子守恒计算气体的体积;用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,甲醇在负极放电,生成CO2和H2O.
解答 解:(1)因为水解反应吸热,故“微热”除能加快反应速率外,同时还可以促进Fe3+水解生成Fe(OH)3而除去,
故答案为:促进Fe3+水解生成Fe(OH)3而除去;
(2)酸化后Cr2O72-可被SO32-还原成Cr3+,SO32-变为SO42-,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;为保证最后得到纯净的硫酸钠,酸C为H2SO4,根据Cr3+完全沉淀(c≤1.0×10-5 mol•L-1)时pH为5,则c(H+)=10-5 mol/L,c(OH-)=10-9 mol•L-1,则Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=(Cr3+)•c3(OH-)=1.0×10-32mol4•L-4,故答案为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;H2SO4;1.0×10-32mol4•L-4;
(3)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成4H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极;电极反应式:2H2O-4e-=O2↑+4H+,阴极电极反应式:2H++2e-=H2↑,
0.2mol 0.05mol 0.2mol 0.1mol,
该装置中产生的气体0.05mol+0.1mol=0.15mol,在标准状况下的体积为0.15mol×22.4L/mol=3.36L;
用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,甲醇在负极放电,反应式为CH3OH-6e-+3CO32-=4CO2+2H2O;
故答案为:正;3.36;CH3OH-6e-+3CO32-=4CO2+2H2O.
点评 本题综合考查了化学平衡原理、氧化还原反应、离子方程式的书写、沉淀溶解平衡和Ksp的有关计算等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.

| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程

(5)写出含有32个电子的元素⑥的氢化物的分子式C4H8
(6)写出工业冶炼⑤的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(7)元素①在氧气中燃烧的产物与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
| A. | 任何状态下,1molCO2和18克水所含的分子数和原子数都相等 | |
| B. | 22.4L的任何气体的物质的量为1mol | |
| C. | 非标准状况下,1mol任何气体的体积必定不是22.4L | |
| D. | 标准状况下,1molSO3的体积是22.4L |
| A. | 同温同压下,H2+Cl2=2HCl在光照和点燃条件的△H不同 | |
| B. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| C. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 | |
| D. | 元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |
| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
| 选项 | 性质 | 应用 |
| A | 油脂在一定条件下能发生水解反应 | 油脂在碱性条件下水解制肥皂 |
| B | 硫酸铵等盐类 能使蛋白质变性 | 可用硫酸铵作杀菌消毒剂 |
| C | 糖类都能发生水解反应 | 可用淀粉、纤维素水解制葡萄糖 |
| D | 明矾溶于水可发生水解反应 | 明矾可用于自来水的净化、杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  |  |  |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |
 有几种元素的微粒电子层结构如图所示,其中:
有几种元素的微粒电子层结构如图所示,其中: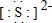 .
.