题目内容
汽车尾气已成为重要的空气污染物.
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.
T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程).
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为 .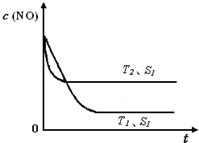
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.
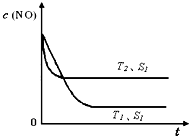
如图是反应:2NO(g)+2CO(g)═2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”).
若催化剂的表面积S1>S2,在图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件.
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.
T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程).
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为

②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.
如图是反应:2NO(g)+2CO(g)═2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
若催化剂的表面积S1>S2,在图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件.
分析:(1)结合方程式N2(g)+O2(g)?2NO(g),利用三段式求出平衡时各物质的浓度,再利用平衡常数公式计算;
(2)①根据已知热化学方程式,利用盖斯定律书写目标热化学方程式;
②根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.
(2)①根据已知热化学方程式,利用盖斯定律书写目标热化学方程式;
②根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.
解答:解:(1)设参加反应的氮气为xmol
N2(g)+O2(g)?2NO(g),
起始(mol) 8 9 0
反应(mol) x x 2x
平衡(mol) 8-x 9-x 2x
平衡时NO物质的量为6mol,所以2x=6mol,则x=3mol,
所以平衡时各物质的浓度为c(N2)=
=
mol/L=1mol/L,c(O2)=1.2mol/L,c(NO)=1.2mol/L,
K=
=
=1.2,
答:该条件下的平衡常数0.12;
(2)①已知:①2NO(g)═N2(g)+O2(g)△H=-180.5kJ?mol-1
②2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ?mol-1
根据盖斯定律,①-②得:2H2(g)+2NO(g)═N2(g)+2H2O(l)△H=-752.1 kJ?mol-1
故答案为:2H2(g)+2NO(g)═N2(g)+2H2O(l)△H=-752.1 kJ?mol-1;
②温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: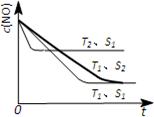 ,
,
故答案为:<; .
.
N2(g)+O2(g)?2NO(g),
起始(mol) 8 9 0
反应(mol) x x 2x
平衡(mol) 8-x 9-x 2x
平衡时NO物质的量为6mol,所以2x=6mol,则x=3mol,
所以平衡时各物质的浓度为c(N2)=
| n |
| V |
| 8-3 |
| 5 |
K=
| c2(NO) |
| c(N2)?c(O2) |
| (1.2mol/L)2 |
| 1mol/L×1.2mol/L |
答:该条件下的平衡常数0.12;
(2)①已知:①2NO(g)═N2(g)+O2(g)△H=-180.5kJ?mol-1
②2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ?mol-1
根据盖斯定律,①-②得:2H2(g)+2NO(g)═N2(g)+2H2O(l)△H=-752.1 kJ?mol-1
故答案为:2H2(g)+2NO(g)═N2(g)+2H2O(l)△H=-752.1 kJ?mol-1;
②温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为:
 ,
,故答案为:<;
 .
.点评:本题主要考查化学反应速率、影响化学平衡的因素、化学平衡图象以及热化学方程式的书写等,难度中等,(3)中注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 汽车尾气已成为重要的空气污染物.
汽车尾气已成为重要的空气污染物.(1)汽车内燃机工作时引起反应:N2(g)+O2(g)=2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO 物质的量为6mol,该反应的速率v(NO)为
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1是反应:
2NO(g)+2CO(g)=2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
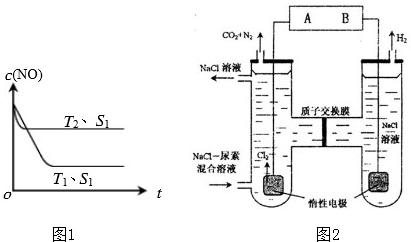
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图2:
①电源的负极为
②阳极室中发生的反应为
③电解结束后,阴极室溶液的pH与电解前相比将
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气的转化率,则
| a |
| b |
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正
 (2012?佛山二模)2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.
(2012?佛山二模)2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.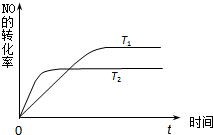 ①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)
①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)