题目内容
11.下列实验或操作能实现的是( )
| A. | 用25 mL酸式滴定管量取20.00 mL KMnO4溶液 | |
| B. | 图1可表示0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 做导电实验时,强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 其它条件相同下,图2可探究Fe3+和Cu2+对H2O2分解反应的催化效果 |
分析 A.KMnO4溶液具有强氧化性,可氧化橡胶管;
B.0.1000mol•L-1CH3COOH溶液,pH≠1;
C.导电能力与离子浓度有关;
D.应控制含Fe3+和Cu2+溶液的阴离子相同.
解答 解:A.KMnO4溶液具有强氧化性,可氧化橡胶管,则用25 mL酸式滴定管量取20.00 mL KMnO4溶液,故A正确;
B.0.1000mol•L-1CH3COOH溶液,pH≠1,图中起点pH=1,与醋酸的pH不同,故B错误;
C.导电能力与离子浓度有关,强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,因浓度未知,故C错误;
D.应控制含Fe3+和Cu2+溶液的阴离子相同,氯化铁与硫酸铜的阴离子不同,则不能探究Fe3+和Cu2+对H2O2分解反应的催化效果,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及仪器的使用、酸碱中和、离子浓度与导电性、影响反应速率的因素等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
2.下列实验中,反应速率加快属于由催化剂引起的是( )
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
19.下列有关乙醇和苯酚的说法中不正确的是( )
| A. | 乙醇和苯酚均无毒,但都能用于消毒、杀菌 | |
| B. | 乙醇和苯酚均能和金属Na反应置换出氢气 | |
| C. | 苯酚能与甲醛反应制造酚醛树脂 | |
| D. | 乙醇的沸点比乙烷高是因为乙醇分子间可以形成氢键 |
6.在100mL1mol•L-1 AlCl3溶液中滴加1mol•L-1NaOH溶液,得到3.9g沉淀,则加入的NaOH溶液的体积可能是( )
| A. | 160mL | B. | 200mL | C. | 300mL | D. | 350mL |
1.前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体.已知H2O2的结构式为H-O-O-H,下列说法中不正确的是( )
| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2分子中只含σ键,不含π键 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
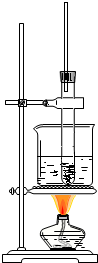 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下: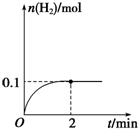 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
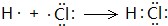 .
.