题目内容
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的-半,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A、钠与W可能形成Na2W2化合物 |
| B、由Z与Y组成的物质不能与酸反应 |
| C、W得电子能力比Q强 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据短周期元素X、Y、Z、W、Q在元素周期表的位置知,X和Y属于第二周期元素,Z、W、Q属于第三周期元素,X元素的原子内层电子数是最外层电子数的-半,则其最外层电子数是4,为C元素,则Y是O元素、Z是Si元素、W是S元素、Q是Cl元素,
A.Na和S反应能生成Na2S、Na2S2;
B.二氧化硅能和HF反应;
C.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其得电子能力越强;
D.氧气和臭氧为氧元素的同素异形体.
A.Na和S反应能生成Na2S、Na2S2;
B.二氧化硅能和HF反应;
C.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其得电子能力越强;
D.氧气和臭氧为氧元素的同素异形体.
解答:
解:根据短周期元素X、Y、Z、W、Q在元素周期表的位置知,X和Y属于第二周期元素,Z、W、Q属于第三周期元素,X元素的原子内层电子数是最外层电子数的-半,则其最外层电子数是4,为C元素,则Y是O元素、Z是Si元素、W是S元素、Q是Cl元素,
A.Na和S反应能生成Na2S、Na2S2,故A正确;
B.二氧化硅能和HF反应,反应方程式为SiO2+4HF=SiF4+2H2O,故B错误;
C.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其得电子能力越强,非金属性Q>W,所以得电子能力Q>W,故C错误;
D.氧气和臭氧为氧元素的同素异形体,金刚石和石墨为C元素的同素异形体,故D错误;
故选A.
A.Na和S反应能生成Na2S、Na2S2,故A正确;
B.二氧化硅能和HF反应,反应方程式为SiO2+4HF=SiF4+2H2O,故B错误;
C.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其得电子能力越强,非金属性Q>W,所以得电子能力Q>W,故C错误;
D.氧气和臭氧为氧元素的同素异形体,金刚石和石墨为C元素的同素异形体,故D错误;
故选A.
点评:本题考查了元素周期表和元素周期律的综合应用,根据元素周期表确定元素,再结合物质的性质、基本概念、元素周期律等知识点来分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组物质可以用分液漏斗分离的是( )
| A、酒精和水 | B、苯和水 |
| C、乙醇和乙酸乙酯 | D、乙酸和水 |
在物质分类中,前者包括后者的是( )
| A、氧化物、化合物 |
| B、化合物、酸性氧化物 |
| C、溶液、胶体 |
| D、溶液、分散系 |
 中国人民银行于2011年10月31日发行2012中国壬辰(龙)年金银纪念币一套.该套纪念币共15枚,其中有七枚纪念币外观为银白色,某同学认为其可能是用铁制成的,于是用磁铁来吸引一下,从化学研究方法的角度来看,“用磁铁吸”是研究物质性质的方法中的( )
中国人民银行于2011年10月31日发行2012中国壬辰(龙)年金银纪念币一套.该套纪念币共15枚,其中有七枚纪念币外观为银白色,某同学认为其可能是用铁制成的,于是用磁铁来吸引一下,从化学研究方法的角度来看,“用磁铁吸”是研究物质性质的方法中的( )| A、实验法 | B、观察法 |
| C、假设法 | D、比较法 |
下列物质熔沸点高低比较正确的是( )
| A、SiO2<CO2 |
| B、CCl4<CF4 |
| C、NaCl<HCl |
| D、HF>HCl |
下列事实中,能够证明HCl是共价化合物的是( )
| A、HCl易溶于水 |
| B、液态的HCl不导电 |
| C、HCl不易分解 |
| D、HCl溶于水能电离,呈酸性 |

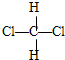 和
和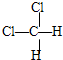 ⑦
⑦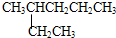 和
和