题目内容
某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式.
第一阶段的反应: ;
第二阶段的反应: .
第一阶段的反应:
第二阶段的反应:
考点:电解原理
专题:电化学专题
分析:某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,溶液中含有的阳离子的放电顺序为:Cu2+>H+>Mg2+,阴离子的放电顺序为:Cl->OH->NO3-,根据离子的放电顺序判断书写.
解答:
解:某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,溶液中含有的阳离子的放电顺序为:Cu2+>H+>Mg2+,阴离子的放电顺序为:Cl->OH->NO3-,所以第一阶段放电的离子为Cu2+和Cl-,第二阶段放电的离子为H+和OH-,所以电解反应的化学方程式第一阶段的反应:CuCl2
Cu+Cl2↑;第二阶段的反应:2H2O
2H2↑+O2↑;
故答案为:CuCl2
Cu+Cl2↑;2H2O
2H2↑+O2↑.
| ||
| ||
故答案为:CuCl2
| ||
| ||
点评:本题考查了电解原理及电极反应式的书写,熟练把握溶液中离子的放电顺序是解决本题的关键,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
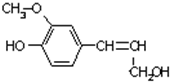 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )| A、该物质的分子式是C10H12O3,属于芳香烃 |
| B、该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
| C、1mol该物质最多能消耗4mol H2 |
| D、1mol该物质与溴水发生反应,可消耗4mol Br2 |
下列溶液中Cl-浓度最小的是( )
| A、100mL 3mol/L NaCl溶液 |
| B、200mL 2.5mol/L MgCl2溶液 |
| C、300mL 2mol/L AlCl3溶液 |
| D、400mL 1mol/L盐酸 |
用惰性电极在一定温度下电解某Na2SO4饱和溶液,当两极共产生标准状况下67.2L气体时,从溶液中析出64.4g Na2SO4?10H2O 晶体.则剩余溶液的溶质质量分数约是( )
| A、64.7% |
| B、47.5% |
| C、32.2% |
| D、28.3% |
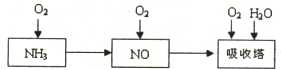 工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下: